|
高中化学知识点总结《无机综合与推断》高频试题强化练习(2019年最新版)(十)
2019-06-25 20:50:42
【 大 中 小】
|
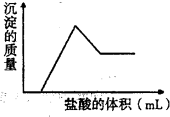
1、选择题 某粉末试样由几种常见氧化物组成.向该粉末试样中加入过量的氢氧化钠溶液,充分溶解后过滤得红棕色固体和无色溶液,向所得无色溶液中滴入盐酸,产生沉淀的质量与所加盐酸的体积的关系如图所示,组成该粉末试样的氧化物可能是( )
A.Fe2O3、MgO、Al2O3
B.Fe2O3、SiO2、Al2O3
C.CuO、SiO2、MgO
D.CuO、MgO、Al2O3
| 
参考答案:B
本题解析:
本题难度:简单
2、填空题 A~G各物质间的关系如下图,其中B、D为气态单质。

请回答下列问题:(①中MnO2作催化剂,②中MnO2作氧化剂)
(1)物质C和E的名称分别为________________、__________________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为_____________;若只能在加热情况下进行,则反应物A应为_____________;
(3)反应②的化学方程式:_______________________________________;
(4)新配制的F溶液应加入_____________以防止其转化为G。检验G溶液中阳离子的常用试剂是_____________,实验现象为____________________________。
参考答案:(1)浓盐酸、四氧化三铁;(2)2H2O2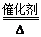 2H2O + O2↑ ; KClO3 2H2O + O2↑ ; KClO3
(3)MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O?(4) 铁粉 , KSCN溶液?溶液变为血红色 MnCl2 + Cl2↑+ 2H2O?(4) 铁粉 , KSCN溶液?溶液变为血红色
本题解析:①中MnO2作催化剂可知:A为H2O2或KClO3;B为O2;E为Fe3O4 , ②中MnO2作氧化剂可与C制气体D且C还与Fe3O4反应生成F和G的混合溶液。可确定:C为浓盐酸;D为Cl2;而G为FeCl3、F为FeCl2。(1)物质C和E的名称分别为浓盐酸、四氧化三铁。(2)进行反应①,若能在常温下进行,A是H2O2其化学方程式为2H2O2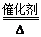 2H2O + O2↑;若只能在加热情况下进行,则反应物A应为KClO3。(3)反应②的化学方程式: MnO2 + 4HCl(浓) 2H2O + O2↑;若只能在加热情况下进行,则反应物A应为KClO3。(3)反应②的化学方程式: MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O.(4)Fe2+有强的还原性,容易被被空气氧化成Fe3+而变质。因此常加入铁粉将变质的Fe3+还原回Fe2+.反应的离子方程式为:2Fe3++Fe=3Fe2+.Fe3+的检验方法是向待测溶液中加入KSCN溶液,若溶液变为血红色,就证明含有Fe3+.或加入NaOH溶液,若产生红褐色的沉淀。就证明含有Fe3+.2 、Cl2的实验室制法Fe3+的检验等知识。 MnCl2 + Cl2↑+ 2H2O.(4)Fe2+有强的还原性,容易被被空气氧化成Fe3+而变质。因此常加入铁粉将变质的Fe3+还原回Fe2+.反应的离子方程式为:2Fe3++Fe=3Fe2+.Fe3+的检验方法是向待测溶液中加入KSCN溶液,若溶液变为血红色,就证明含有Fe3+.或加入NaOH溶液,若产生红褐色的沉淀。就证明含有Fe3+.2 、Cl2的实验室制法Fe3+的检验等知识。
本题难度:一般
3、推断题 某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。

填写下面空白:
(1)图中标号处需加入的相应物质分别是①_______、②_______、③_______、④_______、⑤_______。
(2)写出①处发生反应的离子方程式__________________;_________________;__________________;
___________________;写出③处发生反应的化学方程式________________________。
(3)铁红的化学式为________;分别写出铁红和氧化铜在工业上的一种主要用途:
铁红____________________;氧化铜______________________。
参考答案:(1)①铁屑;②稀硫酸;③稀硝酸;④氢氧化钠;⑤氢氧化钠
(2)Fe+2H+==Fe2++H2↑;2Fe3++Fe==3Fe2+;Cu2++Fe===Cu+Fe2+;2Au3++3Fe==2Au+3Fe2+;
3Cu+8HNO3(稀)==3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3;用作红色颜料;用作制造铜盐的原料
本题解析:
本题难度:一般
4、填空题 组成A、B、C、D分子的元素原子序数均小于10,它们之间能发生如图所示的反应.其中A的水溶液能使酚酞试夜变红,组成B的元素的电负性在周期表中最大.请写出A、B、C、D的化学式:
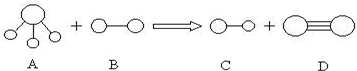
A______;B______;C______;D______.
参考答案:A的水溶液能使酚酞试夜变红,结合A的结构模型可知A为NH3,组成B的元素的电负性在周期表中最大,则B为F元素组成的单质,为F2,结合生成物的结构模型可知生成C为HF,D为N2,发生反应的方程式为2NH3+3F2=6HF+N2,
故答案为:NH3;F2;HF;N2.
本题解析:
本题难度:一般
5、填空题 下图中A~G是化合物,H是一种无色气态单质,D高温下是气体,而常温下是一种无色液体, E为淡黄色的固体。它们之间有如下转化关系:
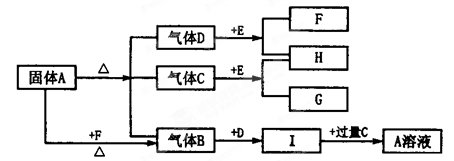
(1)写出A的化学式?;C的结构式?;
(2)A溶液与过量F溶液反应的离子方程式 ?
参考答案:(1)NH4HCO3? O=C=O?(2)NH4++HCO3-+2OH- NH3↑+CO32-+2H2O NH3↑+CO32-+2H2O
本题解析:D常温下是一种无色液体,应为H2O,E是一种淡黄色固体,且能与水反应,则E为Na2O2,C和水都能与Na2O2反应,可知C为CO2,则H为O2,F为NaOH,G为Na2CO3,固体A能与NaOH反应生成气体,且能分解生成水、CO2和B,则A应为碳酸铵或碳酸氢铵,B为NH3,I为氨水溶液,与过量二氧化碳反应生成A,则A为碳酸氢铵,(1)由以上分析可知A为碳酸氢铵,C为CO2,为共价化合物,O=C=O ,(2)A溶液与过量F溶液反应的离子方程式NH4++HCO3-+2OH- NH3↑+CO32-+2H2O。 NH3↑+CO32-+2H2O。
本题难度:一般
| 