1、选择题 已知下列转化关系中M、N均为单质.则M不可能是
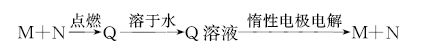
A.Na
B.Cu
C.H2
D.Cl2
参考答案:A
本题解析:由于用惰性电极电解M燃烧产物的水溶液还能产生该单质,说明如果M是金属,则应该是不活泼的金属元素。因为在溶液中活泼的金属阳离子的氧化性比H+弱,产生的就会是H2,而得不到该金属。因此A错误。B正确。若是H2燃烧,无论是在O2中还是在Cl2。产物进行电解都能产生该物质本身。因此C、D都正确。所以选项为A.
本题难度:一般
2、填空题 (13分)已知:正盐A强热可得到B、C、D、E四种物质,B通常情况下为无色无味液体,E、F 是空气主要成分,D能产生酸雨,I为红棕色气体,C与J反应可得A,J、K为两种常见的酸。物质之间的转化关系如图所示(图中部分反应物或生成物及反应条件未列出)。 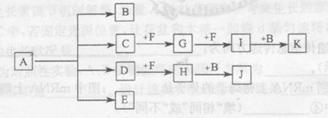
请回答下列问题:
(1)E物质的电子式是________。
(2)检验C的试纸是________,检验D的试剂是________(填试纸、试剂名称)。
(3)写出A强热分解生成B、C、D、E的化学方程式________。
(4)写出D通人FeCl3溶液时,发生反应的离子方程式_____ 。
(5) —定浓度J、K混合后的稀溶液200mL,平均分成两份。向其中一份中逐渐加人铜粉,最多能溶解a g(产生气体只为G)。向另一份中逐渐加人铁粉,产生气体的量随铁粉质量增加的变化如图所示。则①a=________g,②气体G标准状况下体积为________,③J的物质的量浓度为______。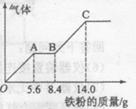
参考答案:(13分)(1) (2分) (2)红色石蕊试纸?品红溶液 (2分)
(2分) (2)红色石蕊试纸?品红溶液 (2分)
(3)3(NH4)2SO4 6H2O+4NH3↑+3SO2↑+N2↑ (3分)
6H2O+4NH3↑+3SO2↑+N2↑ (3分)
(4)SO2+2Fe3++2H2O=SO42-+2Fe2++4H+ (3分)
(5)①9.6g (1分) ②2.24L (1分) ③2.5mol/L (1分)
本题解析:B通常情况下为无色无味液体,因此B应该是水。E、F 是空气主要成分,则二者是氮气和氧气。D能产生酸雨,所以D是SO2。SO2能和F反应生成H,则F是氧气,E是氮气,H是三氧化硫。三氧化硫和水反应生成J,J是硫酸。I为红棕色气体,则I是NO2。G和氧气反应生成NO2,所以G是NO。NO2溶于水生成硝酸和NO。K是酸,则K是硝酸。C和氧气反应生成NO,且C与J反应可得A,所以C是氨气,A就是硫酸铵。
(1)氮气是含有非极性键的单质,其电子式是 。
。
(2)氨气是碱性气体,可用红色石蕊试纸检验;SO2具有漂白性,可用品红溶液检验。
(3)A强热分解生成B、C、D、E的化学方程式3(NH4)2SO4 6H2O+4NH3↑+3SO2↑+N2↑。
6H2O+4NH3↑+3SO2↑+N2↑。
(4)SO2具有还原性,能被铁离子氧化,因此该反应的离子方程式是SO2+2Fe3++2H2O=SO42-+2Fe2++4H+。
(5)硝酸是氧化性酸,所以根据图像可知,O→A发生的反应是Fe+4H++NO3-=Fe3++NO↑+2H2O。A→B发生反应的方程式是2Fe3++Fe=3Fe2+;B→C发生反应的方程式是Fe+2H+=Fe2++H2↑。三阶段中消耗铁的物质的量分别是5.6g÷56g/mol=0.1mol、(8.4g-5.6g)÷56g/mol=0.05mol、(14.0g-8.4g)÷56g/mol=0.1mol,所以根据氮元素守恒可知,硝酸的物质的量是0.1mol。最终溶液中只有硫酸亚铁,则根据原子守恒可知,硫酸亚铁的物质的量是0.25mol,因此硫酸的物质的量也是0.25mol,则硫酸的浓度是0.25mol÷0.1L=2.5mol/L。另一份溶液中,氢离子和NO3-的物质的量分别是0.6mol和0.1mol,则根据方程式3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,氢离子过量,所以NO3-完全被还原生成NO,则NO的物质的量是0.1mol,在标准状况下的体积是2.24L。其中溶解铜的质量是0.15mol×64g/mol=9.6g。
本题难度:困难
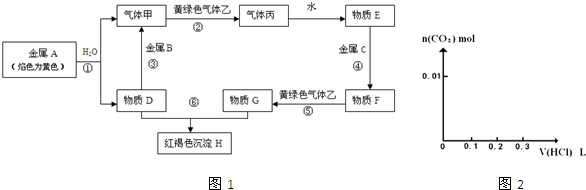
3、简答题 现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如图1所示(图中有些反应的生成物和反应的条件没有标出).
请回答下列问题:
(1)写出下列物质的化学式:B______、丙______、乙______.
(2)写出下列反应的离子方程式:
反应①______;
反应⑤______;
反应⑥______.
(3)将0.4gD和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol?L-1稀盐酸.在如图2所示的坐标系中画出能正确表示加入盐酸的体积和生成CO2的物质的量的关系图象.______.
参考答案:金属A颜色反应为黄色证明为Na,与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应,说明B为Al,气体甲和氯气反应生成丙为HCl,物质E为盐酸溶液,物质D氢氧化钠和物质G为反应生成红褐色沉淀H为Fe(OH)3,G为FeCl3,推断物质F为FeCl2,C为Fe,
(1)由上述分析可知,B为Al,丙为HCl,乙为Cl2,故答案为:Al;HCl;Cl2;
(2)反应①为2Na+2H2O=2Na++2OH-+H2↑,反应⑤为Cl2+2Fe2+=2Fe3++2Cl-,反应⑥为Fe3++3OH-=Fe(OH)3↓,
故答案为:2Na+2H2O=2Na++2OH-+H2↑;Cl2+2Fe2+=2Fe3++2Cl-;Fe3++3OH-=Fe(OH)3↓;
(3)0.4gNaOH和1.06gNa2CO3混合并配成溶液,向溶液中滴加0.1mol?L-1稀盐酸,先发生NaOH+HCl=NaCl+H2O,消耗0.1L盐酸,然后发生Na2CO3+HCl=NaCl+NaHCO3,消耗0.1L盐酸,且不生成二氧化碳,最后发生NaHCO3+HCl=NaCl+H2O+CO2↑,消耗0.1L盐酸生成0.01mol二氧化碳,如图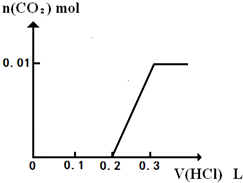 ,
,
故答案为: .
.
本题解析:
本题难度:一般
4、选择题 某单质A经如图所示的过程转化为D:下列说法正确的是( )
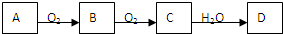
A.若A为金属单质,则D为难溶性碱
B.A只能为非金属单质
C.若A为非金属单质,D为弱酸,则A可能为碳
D.若A为非金属单质,D为强酸,则A一定为硫
参考答案:C
本题解析:
本题难度:简单
5、推断题 (原创)(12分)有四种元素A、B、C、D,其中元素B的单质是能使带火星木条复燃的气体,元素D的单质在常温下是一种黄色固体。A、C、D的单质都能在B的单质中燃烧,分别生成化合物X、Y、Z, 化合物X、Z均能使澄清的石灰水变浑浊,X是一种无毒气体,化合物Y是一种淡黄色固体。
请回答列下问题:
(1)写出下列元素的元素符号:A ?,B ,C ??, D ?。
(2)D元素原子形成的简单离子的离子符号为 ??。
(3)写出化合物X与Y反应的化学方程式 ;
(4)物质Z可以使氯水褪色,写出该反应的离子方程式 ;
参考答案:(12分)
(1)? C? O? Na? S(每空1分 ,共4分)
(2)S2?(2分)
(3)2Na2O2 + 2CO2 =2Na2CO3?+ O2(3分)
(4)SO2 +Cl2 + 2H2O=4H+ + SO4 2?+ 2Cl?(3分)
本题解析:有四种元素A、B、C、D,其中元素B的单质是能使带火星木条复燃的气体,说明B是氧元素,元素D的单质在常温下是一种黄色固体。说明D是S,A、C、D的单质都能在B的单质中燃烧,分别生成化合物X、Y、Z, 化合物X、Z均能使澄清的石灰水变浑浊,X是一种无毒气体,说明x是二氧化碳吗,z是二氧化硫,,则,A是碳元素,C是钠元素,D是硫元素,化合物Y是一种淡黄色固体是过氧化钠。)D元素原子形成的简单离子的离子符号为S2?;
化合物X与Y反应的化学方程式是2Na2O2 + 2CO2 =2Na2CO3?+ O2;物质Z可以使氯水褪色,该反应的离子方程式是SO2 +Cl2 + 2H2O=4H+ + SO4 2?+ 2Cl?。
点评:抓住题目的突破口,是解决无机推断题的关键。题目中的突破口可能是显性的,也可能是隐性的。显性的突破口通常是指物质特殊的物理、化学性质、用途以及一些特征的反应现象;而隐性的突破口则往往是一些特殊的反 应类型或者物质之间的转化关系。
本题难度:一般