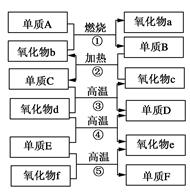
1、选择题 元素A的单质及A与B形成的化合物能按如图所示的关系发生转化。则下列说法正确的是

[? ]
A.图中物质间的转化都不是氧化还原反应
B.当n=1时,A可能是N2
C.A一定是金属元素
D.当n=2时,A可能是Fe
参考答案:D
本题解析:
本题难度:简单
2、填空题 下图是化学中部分常见的氧化物和单质的转化关系。其中,氧化物f是制造光导纤维的重要原料,氧化物c是一种具有磁性的黑色物质。回答下列问题:
(1)写出下列物质的化学式:单质F________,氧化物d________。
(2)写出下列反应的化学方程式:
①_____________________________________________;
④_____________________________________________。
参考答案:(1)Si H2O
(2)①2Mg+CO2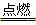 C+2MgO ④C+H2O(g
C+2MgO ④C+H2O(g )
) CO+H2
CO+H2
本题解析:略
本题难度:一般
3、填空题 (16分)A、B、C、D都是中学化学中的常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去)。
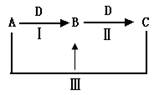
(1)若A是一种强碱,C为厨房中的用品。
①反应Ⅲ的离子方程式是__________________________________。
②下列有关B、C的说法正确的是?
A.向B的饱和溶液中通入D,将有晶体析出
B.可以用BaCl2或CaCl2稀溶液或Ba(OH)2稀溶液鉴别B、C两种溶液
C.分别取等质量的B、C两种固体与足量盐酸反应C产生气体多
D.取a克B、C的混合物充分加热,固体质量减重b克,由此可计算出混合物中B的质量分数
E.取a克B、C的混合物与足量稀硫酸充分反应,逸出的气体用碱石灰完全吸收,增重b克, 由此可计算出混合物中B的质量分数
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①反应Ⅲ的离子方程式是__________________________________。
②向沸水中逐滴加入5~6滴B的饱和溶液,继续煮沸至溶液呈红褐色,该反应的化学方程式为:?。区分该分散系与其它分散系最本质的特征是?。
⑶若常温下A、C是气体,B是固体。
①反应Ⅲ的化学方程式是__________________________________.
有两瓶经过C气体和(2)中的A气体漂白的品红溶液,如何通过简单实验进行鉴别??
?
?。
③在BaCl2溶液中通入C气体,未见沉淀生成,若先通入下列的另一种气体,再通入C;或者向通入C气体的BaCl2溶液中加入下列物质,可以看到沉淀的有_______(填序号)。
A、Cl2? B、NH3? C、HCl? D、CO2?E、KNO3?
参考答案:(16分,每空2分)(1)①HCO3-+OH-="==" H2O+CO32-?②ACD
(2)①Cl2+2Fe2+===2Cl-+2Fe3+? ②FeCl3+3H2O ?Fe(OH)3(胶体)+3HCl
?Fe(OH)3(胶体)+3HCl
分散质微粒直径在1~100 nm之间。
(3)①SO2+2H2S===3S↓+2H2O
②分别取少量经漂白的品红溶液于试管中,加热,恢复红色的是经过C气体漂白的品红溶液,不能恢复红色的是经过(2)中的A气体漂白的品红溶液
③ABE
18、
本题解析:本题为开放性试题,由转化关系,我们很容易想到,①连续氧化、②碱、正盐、酸式盐等。(1)A为强碱,为NaOH、Na2CO3、NaHCO3;(2)D红棕色颜料为Fe2O3,故A:Cl2、D:Fe;(3)C气体漂泊品红,并与Cl2的原理不一样,为SO2,改组为连续氧化得到:H2S→S→SO2。
本题难度:一般
4、填空题 (16分)已知A、B、C、D、E、G、H、I均为气体,J为常见的液态物质,A、B、C、I、M为单质,且M为常用金属,G和H相遇时产生白烟,它们存在如下的转化关系(图中部分反应物或产物已省略),请回答有关问题:
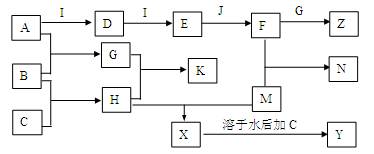
(1)A分子的电子式是?,G分子的空间构型为?。
(2)常温下,pH值均为5的H溶液和K溶液中由水电离的c(H+)之比为?。
(3)若向X的水溶液中通入G,产生的现象是?,N与X中都含M的元素,其化合价是否相同?。
(4)写出X+C→Y的离子方程式?。
M与气态J在高温时反应的化学方程式是?。
(5)土壤胶粒带负电,含相同质量A元素的Z和K施用到稻田后,效果更好的是? -?(填化学式)。
(6)在通常状况下,若1 g B气体在C气体中燃烧生成H气体时放出92.3 kJ热量,则2 mol H气体完全分解生成C气体和B气体的热化学方程式为?。
参考答案:(16分)(1)∶N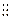 N∶(1分)?三角锥型(1分)(2)1*10-4(2分)。
N∶(1分)?三角锥型(1分)(2)1*10-4(2分)。
(3)先产生白色沉淀,又迅速变为灰绿色,最后变为红褐色(2分)不一定相同(2分)
(4)2Fe2++Cl2=2Cl-+2Fe3+(2分)? 3Fe+4H2O Fe3O4+4H2?(2分)
Fe3O4+4H2?(2分)
(5)NH4Cl(2分)?
?
本题解析:略
本题难度:一般
5、填空题 下图中A、B、C、D、E为单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物。已知①C+G→B+H,放出大量的热,该反应曾应用于铁轨的焊接,G物质是磁铁矿的主要成分,②I是一种常见的温室气体,它和E发生反应:2E+I→2F+D,F中E元素的质量分数为60%,回答下列问题(每空2分,共12分)
(1)反应①的化学方程式是?
(2)化合物I中所存在的化学键是?键(填“离子”或“极性”或“非极性”)
(3)称取11.9gB、C、E的混合物,用过量的NaOH溶液溶解后,过滤、称量剩余固体质量为9.2g,另取等质量的B、C、E的混合物用稀硝酸完全溶解,共收集到标况下气体6.72L,向剩余的混合液,加入过量的NaOH溶液使其中的金属离子完全沉淀,则沉淀的质量为(?)
A.27.2g? B.7.8g? C.2.7g? D.19.4g
(4)C与过量的NaOH溶液反应的离子方程式是:?
(5)将G溶于过量的稀盐酸中,欲检验其中的Fe3+的方案是?,欲检验其中的Fe2+的方案是?
A.滴加KSCN溶液,溶液变血红色?
B.加铁粉,溶液变浅绿色?
C.滴入酸性KMnO4溶液,迅速褪色?
D.滴加NaOH溶液,有白色沉淀且迅速变成灰绿色最后转化为红 褐色
褐色
参考答案:(1)反①的化学方程式是 8Al+3Fe3O4=9Fe+4Al2O3
(2)化合物I中所存在的化学键是极性键
(3)D
(4)离子方程式是:2Al+2OH-+2H2O=2AlO- 2+3H2↑
(5)A,C
本题解析:略
本题难度:简单