1、选择题 在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y所围成的空间构型为正八面体型(如 图)。该晶体可能是
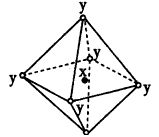
[? ]
A.NaCl
B.CsCl
C.CO2
D.SiO2
参考答案:A
本题解析:
本题难度:简单
2、填空题 工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高.
(1)基态钛原子的核外电子排布式为______.
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于______晶体.
(3)SO42-和?S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.下列说法正确的是______.
A.SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42-稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是______,原因是______.
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为______,分子的空间构型为______.
(6)在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比为______.

参考答案:(1)Ti的原子序数为22,位于周期表第四周期ⅡB族,核外电子排布为[Ar]3d24s2,
故答案为:[Ar]3d24s2;
(2)两种氯化物的熔沸点较低,应属于分子晶体,故答案为:分子;?
(3)A.SO42-中只存在σ键,故A错误;
B.S2O82-中含有S-S键,为非极性键,有强氧化性,故B正确;
C.SO42-和?S2O82-中S元素的化合价分别为+6价和+7价,两者的氧元素的化合价不同,故C错误,
故答案为:B;
(4)影响离子晶体熔沸点高低的因素有半径因素和电荷因素,而Mg2+与O2-半径和小于K+与Cl-半径和且MgO中阴阳离子所带电荷均比KCl中阴阳离子所带电荷多,故MgO晶格能比KCl大,熔点高,
故答案为:MgO;均为离子晶体,而Mg2+与O2-半径和小于K+与Cl-半径和且MgO中阴阳离子所带电荷均比KCl中阴阳离子所带电荷多,故MgO晶格能比KCl大,熔点高;?
(5)价层电子对数为6+22=4,孤电子对数为6-22=2,所以杂化类型为sp3杂化,分子为V形结构,
故答案为:sp3、V形(折线形);?
(6)图1中Fe位于体心和顶点,铁的配位数为8,图2中Fe位于顶点和面心,距离最近的为顶点和面心的铁原子,有12个,所以配位数为12,二者比值为8:12=2:3,
故答案为:2:3.
本题解析:
本题难度:一般
3、选择题 超临界流体是介于气态和液态之间的一种新的状态。目前应用最广的是超临界二氧化碳,在化学工业上可取代氟利昂等溶剂、发泡剂。下列有关超临界二氧化碳的说法中错误的是(?)
A.超临界二氧化碳由CO2分子构成
B.超临界二氧化碳是新合成的一种物质
C.用超临界二氧化碳溶解物质后,可在常温常压下使二氧化碳挥发除去
D.用超临界二氧化碳代替氟利昂可减轻对臭氧层的破坏
参考答案:B
本题解析:CO2不是一种新合成的物质,所以选项B是错误的;
本题难度:一般
4、简答题 A、B、C、D、E五种元素中,A原子第三能层轨道上成对电子数等于未成对电子数,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,C的价电子排布式为nsnnpn+2,D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:
(1)A的最高价氧化物的化学式为______,中心原子的VSEPR构型为______.
(2)AC2与BC2分子的立体结构分别是______和______,相同条件下两者在水中的溶解度较大的是______(写分子式),理由是______.
(3)D的元素符号是______,它的价电子排布式为______,在形成化合物时它的最高化合价为______.
(4)用氢键表示式写出E的氢化物的水溶液中存在的所有氢键______.
参考答案:A原子第三能层轨道上成对电子数等于未成对电子数,价电子排布应为3s23p4,应为S元素,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,应为1s22s22p2,应为C元素,C的价电子排布式为nsnnpn+2,n应为2,则C应为O元素,D的核电荷数是A与C的核电荷数之和,则原子序数为24,应为Cr元素,E在元素周期表的各元素中电负性最大,应为F元素,
(1)A为S,最高价氧化物为SO3,形成3个δ键,且没有孤电子对,为平面三角形分子,故答案为:SO3;平面三角形;
(2)AC2与BC2分别为SO2和CO2,SO2中形成2个δ键,且有1个孤电子对,为V形,CO2中形成2个δ键,且没有孤电子对,为直线形分子,SO2为极性分子,易溶于水,
故答案为:V形;直线形;SO2;SO2与水都为为极性分子,根据相似相溶的性质可知易溶于水;
(3)D为Cr,它的价电子排布式为3d54s1,价层电子为6,则最高化合价为+6价,故答案为:Cr,3d54s1;+6;
(4)E为F元素,电负性较大,对一个的氢化物含有氢键,水溶液中含有F-H…F、F-H…O、O-H…F、O-H…O等氢键,故答案为:F-H…F、F-H…O、O-H…F、O-H…O.
本题解析:
本题难度:一般
5、选择题 共价健、离子键、金属键、分子间作用力都是微粒间的作用力,含有以上两种作用力的晶体是……( )
A.SiO2
B.CCl4
C.NaCl
D.金刚石
参考答案:B
本题解析:SiO2只含共价键,NaCl只含离子键,金刚石只含共价键,而CCl4是分子晶体,含共价键和分子间作用力。
本题难度:一般