|
|
|
高考化学知识点整理《认识晶体》练习题(七)
2019-06-25 20:59:17
【 大 中 小】
|
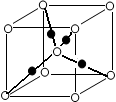
1、选择题 如图所示的是某原子晶体A空间结构的一个单元,A与某物质B反应生成C,其实质是每个A-A键中插入一个B原子,则C物质的化学式为( ? )
A.AB
B.AB4
C.AB2
D.A2B5
| 
2、选择题 下列对化学知识概括合理的是(?)。
A.原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
B.同素异形体之间的转化都是物理变化
C.原子晶体的熔点不一定比金属晶体的高,分子晶体的熔点不一定比金属晶体的低
D.一种元素可能有多种氧化物,但同种化合价只对应一种氧化物
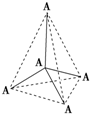
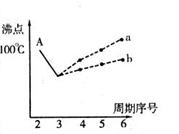
3、填空题 (选做题)(19分)图表法、模型法是常用的科学研究方法。
I.下图是研究部分元素的氢化物的沸点变化规律的图像。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b(其中A点对应的沸点是100℃),你认为正确的是?,理由是?。
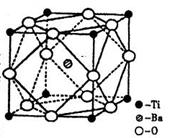
II.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
(1)22Ti元素基态原子的价电子层排布式为?。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,价电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,则它的化学式是?。
III.上世纪60年化,第一个稀有气体化合物Xe[PtF6]被合成出来后,打破了“绝对情性”的观念。在随后的几年内,科学家又相继后成了氙的氟化物、氧化物等。
(1)金属Pt内部原子的堆积方式与铜及干冰中的CO2相同,右图正方体是Pt晶胞的示意图,试说出Pt原子在晶胞中的位置?。

(2)稀有气体(氡除外)中,只有较重的氙能合成出多种化合物,
其可能原因是?(填字母代号)
A.氙的含量比较丰富
B.氙的相对原子质量大
C.氙原子半径大,电离能小
D.氙原子半径小,电负性大
|
(3)已知XeO3分子中氙原子上有1对弧对电子,则XeO3为
?分子(填“极性”或“非极性”)。
4、填空题 纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:

(1)某同学根据上述信息,推断B的核外电子排布如右图所示,该同学所画的电子排布图违背了?。
(2)ACl2分子中A的杂化类型为? 。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确? ,并阐述理由? 。
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物, 其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式?,该物质的K原子和C60分子的个数比为? 。

(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 ,NCl3分子的VSEPR模型为 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为________。
5、填空题 [物质结构与性质](15分)
下表为长式周期表的一部分,其中的序号代表对应的元素。
①
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ②
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ③
| ④
| ⑤
| ⑥
| ?
|
?
| ⑦
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ⑧
| ?
|
?
| ?
| ?
| ?
| ?
| ⑨
| ?
| ?
| ?
| ?
| ⑩
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
(1)写出上表中元素⑨原子的外围电子排布式__________。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为__________杂化;元素⑦与⑧形成的化合物的晶体类型是__________。
(3)元素④的第一电离能__________元素⑤(填写“>”“=”或“<”)的第一电离能;元素④与元素①形成的最简单的X分子的空间构型为__________。请写出与元素④的单质互为等电子体分子、离子的化学式__________(各写一种)。
(4)在测定元素①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是_______。
(5)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,该反应的化学方程式为__________。
(6)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,反应的离子方程式为__________;元素⑩的某种氧化物的晶体结构如图所示,其中实心球表示元素⑩原子,则一个晶胞中所包含的氧原子数目为__________。