| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《认识晶体》练习题(八)
 参考答案:C 本题解析: 本题难度:一般 2、选择题 下列对化学知识概括合理的是(?)。 参考答案:C 本题解析:稀有气体的晶体中不含有化学键,A项错;3O2 本题难度:一般 3、填空题 (选做题)(19分)图表法、模型法是常用的科学研究方法。 |
参考答案:
Ⅰ.b(2分)
A点所示的氢化物是水,其沸点高是由于在水分子间存在多条结合力较大的氢键,总强度远远大于分子间作用力,所以氧族元素中其它氢化物的沸点不会高于水。(4分)
Ⅱ.(1)3d24s2(2分)?(2)BaTiO3(3分)
Ⅲ.(1)正方体的八个顶点和六个面心(4分)
(2)C(2分)
(3)极性(2分)
本题解析:略
本题难度:简单
4、填空题 纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
(1)某同学根据上述信息,推断B的核外电子排布如右图所示,该同学所画的电子排布图违背了?。
(2)ACl2分子中A的杂化类型为? 。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确? ,并阐述理由? 。
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物, 其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式?,该物质的K原子和C60分子的个数比为? 。
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 ,NCl3分子的VSEPR模型为 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为________。
参考答案:(1)能量最低原理?
(2)sp杂化
(3)否;C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键
(4)4s1;3︰1
(5)N>C>Si;正四面体;30
本题解析:
本题难度:一般
5、填空题 [物质结构与性质](15分)
下表为长式周期表的一部分,其中的序号代表对应的元素。
| ① | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| ? | ② | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ③ | ④ | ⑤ | ⑥ | ? |
| ? | ⑦ | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ⑧ | ? |
| ? | ? | ? | ? | ? | ⑨ | ? | ? | ? | ? | ⑩ | ? | ? | ? | ? | ? | ? | ? |
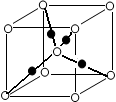
参考答案:(1)3d54s1;(2)sp2;离子晶体;(3)>;三角锥形;CO;CN-(其他合理答案);(4)HF气态时会形成(HF)n分子(或HF分子间会形成氢键)(5)4Mg+10HNO3=4Mg(NO3)2+NH4NO3+3H2O;(6)Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;2
本题解析:根据题意可知:①是H;②是Be;③是C;④是N;⑤是O;⑥是F;⑦是Mg;⑧是Cl;⑨是Cr;⑩是Cu。(1)根据元素在周期表中的位置可知:上表中元素⑨是Cr,其原子的外围电子排布式3d54s1;(2)在元素③C元素与①H元素形成的水果催熟剂气体化合物C2H4中,元素③的杂化方式为sp2;元素⑦与⑧形成的化合物MgCl2的晶体类型是离子晶体;(3)元素④的第一电离能大于⑤的第一电离能,原因是N原子核外的电子处于该原子轨道的半充满的稳定状态。元素④与元素①形成的最简单的X分子NH3的空间构型为三角锥形;与元素④的单质互为等电子体分子是CO、离子的化学式是CN-;(4)在测定元素①与⑥形成化合物HF的相对分子质量时,实验测得的值一般高于理论值的主要原因是在HF分子之间存在氢键,使分子一几个分子聚合在一起以聚合分子(HF)n的形式存在,(5)元素④的最高价氧化物对应的水化物稀溶液与元素⑦的单质反应时,元素④被还原到最低价,根据元素的原子结构及氧化还原反应中的电子守恒可知该反应的化学方程式为4Mg+10HNO3= 4Mg(NO3)2+ NH4NO3+ 3H2O;(6)将过量的NH3通入含有元素⑩的蓝色硫酸盐溶液中,反应的离子方程式为Cu2++2NH3·H2O= Cu(OH)2↓+2NH4+,Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;根据元素⑩的某种氧化物的晶体结构所示,可知:在一个晶胞中含有Cu:4;含有O:8×1/8+1=2则一个晶胞中所包含的氧原子数目为2个。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《三氧化硫》高频考.. | |