|
|
|
高考化学知识点总结《电解池原理》高频试题预测(2019年最新版)(一)
2019-06-25 21:00:59
【 大 中 小】
|
1、选择题 下列解释事实的方程式不正确的是
A.向氯化铝溶液中滴加过量氨水,生成白色胶状沉淀:Al3++ 3NH3·H2O===Al(OH)3+ 3NH4+
B.加入足量的氢氧化镁以除去氯化镁溶液中的少量氯化铁:Fe3+ + 3OH—="=" Fe(OH)3↓
C.常温下0.1mol/L 氯化铵溶液pH=5:NH4+ +H2O 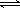 NH3·H2O+ H+ NH3·H2O+ H+
D.电解精炼铜时阳极铜溶解:Cu — 2e— ="==" Cu2+
|
2、选择题 以铁为阳极,铜为阴极,对足量的NaOH溶液进行电解,一段时间后得到2 mol Fe(OH)3沉淀。此过程中共消耗水 ( )
A.3 mol
B.4 mol
C.5 mol
D.6 mol
|
3、简答题 已知pH为4~5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解.某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(m)以及电极上产生气体的体积(V?mL?标准状况)来测定Cu的相对原子质量,过程如下:
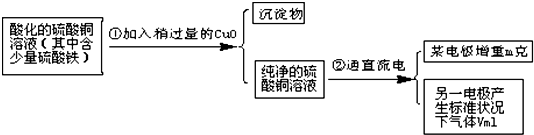
回答下列问题:
(1)加入CuO的作用是______.
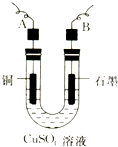
(2)步骤②中所用的部分仪器如图所示,则A、B分别连直流电源的______极和______极
(填“正”或“负”).
(3)电解开始后,电解的离子方程式为______.
(4)下列实验操作中必要的是______(填写字母).
A.称量电解前的电极的质量;
B.电解后,电极在烘干称量前,必须用蒸馏水冲洗;
C.刮下电解后电极上析出的铜,并清洗,称量;
D.电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行;
E.在有空气存在的情况下,烘干电极必须用低温烘干的方法.
(5)铜的相对原子质量为______(用带有m、V的计算式表示).
4、填空题 从H+、K+、Cu2+、Cl-、SO 中选取适当的离子组成符合下列情况的电解质,进行电解(阳离子只能使用一次)。
中选取适当的离子组成符合下列情况的电解质,进行电解(阳离子只能使用一次)。
(1)以碳棒为电极进行电解,电解质的物质的量减少,水的物质的量保持不变,两极都有气体生成,气体体积相同,则该电解质的化学式为____________,电解的阴极反应____________,电解的阳极反应________________________,电解的总方程式是______________________。
(2)以铂丝为电极进行电解,水的物质的量减少,电解质的物质的量保持不变,两极都有气体生成,气体体积比为2:1,则该电解质的化学式为____________________,阴极反应式为____________________,阳极反应式为___________________________。
(3)惰性电解,电解质的物质的量减少,水的物质的量也减少,pH下降,则电解质的化学式为____________,电解的总方程式为__________________________________。
5、填空题 (16分)I.一定条件下铁可以和CO2发生反应:
Fe(s)+CO2(g) FeO(s)+CO(g) △H>0。1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H>0。1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
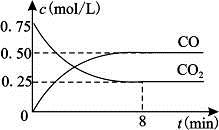
(1)8分钟内,CO的平均反应速率v(CO)=___________(结果保留3位有效数字)。
(2)1100℃时该反应的平衡常数K= (填数值);该温度下,若在8分钟时CO2和CO各增加0.5mol/L,此时平衡 移动(填“正向”、“逆向”或“不”)。
(3)1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器
| 甲
| 乙
|
反应物投入量
| 3molFe、2molCO2
| 4molFeO、3molCO
|
CO的浓度(mol/L)
| C1
| C2
|
CO2的体积分数
| φ1
| φ2
|
体系压强(Pa)
| P1
| P2
|
下列说法正确的是___________(填序号);
A.2C1 = 3C2 B.φ1 = φ2 C.P1<P2
II.(4)已知:①Fe(OH)3(aq)

Fe3+(aq)+3OH-(aq);ΔH=" a" kJ?mol-1
②H2O(l)

H+(aq)+OH-(aq);ΔH="b" kJ?mol-1
请写出Fe3+发生水解反应的热化学方程式:
。
(5)柠檬酸(用H3R表示)可用作酸洗剂,除去水垢中的氧化铁。
溶液中H3R、H2R-、HR2--、R3-的微粒数百分含量与pH的关系如图所示。图中a曲线所代表的微粒数的百分含量随溶液pH的改变而变化的原因是
(结合必要的方程式解释)。调节柠檬酸溶液的pH=4时,溶液中上述4种微粒含量最多的是
(填微粒符号)。

III.(6)高铁酸钠(Na2FeO4)广泛应用于净水、电池工业等领域,工业常用电解法制备,其原理为
Fe+2OH--+2H2O

FeO42--+3H2↑
请设计一个电解池并在答题卡的方框内画出该装置的示意图并作相应标注。

其阳极反应式为:________________________________。


 中选取适当的离子组成符合下列情况的电解质,进行电解(阳离子只能使用一次)。
中选取适当的离子组成符合下列情况的电解质,进行电解(阳离子只能使用一次)。 FeO(s)+CO(g) △H>0。1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(s)+CO(g) △H>0。1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
 Fe3+(aq)+3OH-(aq);ΔH=" a" kJ?mol-1
Fe3+(aq)+3OH-(aq);ΔH=" a" kJ?mol-1 H+(aq)+OH-(aq);ΔH="b" kJ?mol-1
H+(aq)+OH-(aq);ΔH="b" kJ?mol-1
 FeO42--+3H2↑
FeO42--+3H2↑