1、选择题 将铝片投入硫酸铜溶液中,会出现下列现象:铝片表面立刻有紫红色物质沉积,同时产生较多气泡,继而产生蓝色沉淀,混合物温度升高甚至发烫,产生气泡速率明显加快,铝片上下翻滚,溶液中出现黑色物质……。对以上现象的说法错误的是(? )
A.铝片表面的紫红色沉积物为Cu ,离子方程式为2Al+3Cu2+=3Cu+2Al3+
B.生成的气体是H2,生成的蓝色沉淀为Cu(OH)2,产生该现象的离子方程式为3Cu2++6H2O+2Al=3Cu(OH)2↓+3H2↑+2Al3+
C.一段时间后反应速率明显加快的原因一定是;反应放热,使溶液温度升高,反应速率加快
D.溶液中出现的黑色物质可能是氧化铜
参考答案:C
本题解析:铝比铜活泼,和硫酸铜可发生置换反应生成铜,A正确。进而构成原电池,铝是负极加快反应速率,氢离子在正极放电,所以选项C是错误的。反应放热,有可能使氢氧化铜分解生成氧化铜,所以答案选C。
本题难度:一般
2、实验题 (16分)铁、铝、铜等金属及其化合物在日常生活应用广泛,请根据下列实验回答问题:
(1)生铁中含有一种铁碳化合物X(Fe3C)。 X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸的溶液中含有的大量阳离子是?;X与过量浓硝酸反应后溶液中含有的盐的化学式?,检验该盐溶液中含有的阳离子的试剂为________________
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等四种离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧并将灼烧后的固体投入过量的稀盐酸,所得溶液与原溶液相比,溶液中大量减少的阳离子是________
A.Mg2+? B.Fe2+?C.Al3+?D.Cu2+
(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
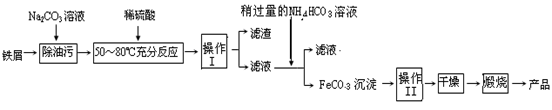
回答下列问题:
①操作Ⅰ的名称是?,操作Ⅱ的名称是?;
操作操作Ⅱ的方法为_____________________________________________________________
_______________________________________________________________________________
②Na2CO3溶液可以除油污,原因是(用离子方程式表示)?;
③请完成生成FeCO3沉淀的离子方程式:Fe2+ + HCO3-? FeCO3↓+ ??+ H2O
(4)有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO4-+8H+===
5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除
天平、玻璃棒、烧杯、胶头滴管外,还需?。
②该实验中的KMnO4溶液需要酸化,用于酸化的酸是?。
a.稀硝酸? b.稀盐酸? c.稀硫酸? d.浓硝酸
③某同学设计的下列滴定方式,最合理的是?(夹持部分略去)(填字母序号)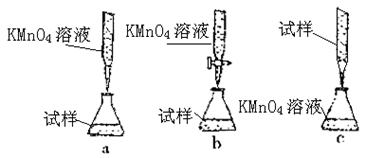
参考答案:(1)Fe2+? Fe3+? H+;Fe(NO3)3?KSCN溶液
(2)BC?;
(3)①过滤,洗涤;在漏斗中加入适量蒸馏水,没过沉淀, 让蒸馏水自然流下,重复数次.
② CO32- + H2O 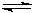 ?HCO3- + OH-
?HCO3- + OH-
③? Fe2+ + 2HCO3- = FeCO3↓+ CO2 ↑ + H2O;
(4)①250mL容量瓶?②c?③b
本题解析:(1)磁性的固体Y应该是四氧化三铁,所以与足量盐酸反应后,溶液中的阳离子分别是Fe2+、Fe3+、H+。
由于硝酸足量,故金属铁元素一定以Fe(NO3)3的形式存在
一般用KSCN溶液来检验Fe3+的存在
(2)氢氧化钠是过量的,因此得不到氢氧化铝沉淀。又因为氢氧化亚铁极易被氧化生成氢氧化铁,所以滤渣应该是氢氧化铁、氢氧化镁和氢氧化铜。滤渣灼烧后生成氧化铁、氧化镁和氧化铜,与足量盐酸反应生成氯化铁、氯化镁和氯化铜,因此所得溶液与原溶液相比,溶液中大量减少的阳离子是Fe2+、Al3+,即答案选BC。
(3)①滤渣从溶液中分离出的方法是过滤,即操作I的名称是过滤。碳酸亚铁沉淀在烘干、煅烧之前必须进行洗涤,所以操作Ⅱ的名称是洗涤。
②Na2CO3溶液由于水解呈碱性:CO32- + H2O 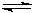 ?HCO3- + OH-,在碱性条件下油脂可水解为可溶性物质
?HCO3- + OH-,在碱性条件下油脂可水解为可溶性物质
③滤液中FeSO4与加入的NH4HCO3反应生成了FeCO3沉淀,为保证电荷守恒及元素守恒,产物中必须还有CO2及水生成:Fe2+ + 2HCO3- = FeCO3↓+ CO2 ↑ + H2O
(4)①由于是配制250ml溶液,所以还需要250 mL容量瓶。
②由于高锰酸钾溶液具有强氧化性,盐酸在常温下即可被其氧化,故一般用稀硫酸酸化,所以答案选c(硝酸不论稀、浓均具有强氧化性,一般不作为酸化溶液)
③由于待测溶液水解呈酸性,不能用碱式滴定管盛放,排除c;高锰酸钾溶液具有强氧化性,不能用碱式滴定管盛放,排除a;故选项b符合题意
本题难度:简单
3、填空题 某同学实验探究氨气的还原性并进行系列实验。
(1)将光亮的紫红色铜丝绕几圈后,在酒精灯火焰上加热,等铜丝变黑后,趁热将铜丝插入疏松的氯化铵晶体里,即刻发现有白色烟雾生成,拿出铜丝后,铜丝又转变为光亮的紫红色。在焊接铜器时用氯化铵除去铜器表面的氧化铜即利用了该原理,请完成该反应:

(2)利用下列装置,进行与金属氧化物MxOy反应生成M、H2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。
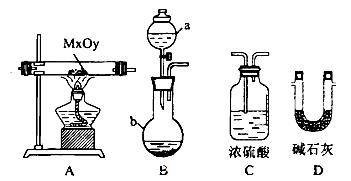
①仪器a的名称为__________,仪器b中装人的试剂可以是____________.
②按气流方向正确的装置连接顺序为(填序号,装置可重复使用):___________。
③实验结束时,应首先__________(填序号)。
I.熄灭A装置的酒精灯
II.停止从a中滴加液体
④若实验中准确称取金属氧化物的质量为mg,完全反应后,测得生成水的质量为ng,则M的相对原子质量为__________(用含X、y、m、n的式子表示)。
(3)若金属氧化物MxOy为Fe2O3,将反应后固体溶于稀硫酸,然后滴加KSCN溶液没发生明显变化。推测该固体成分可能是(将化学式填人下表,你认为有几种可能填几种)。

参考答案:(1)4CuO + 2NH4Cl="3Cu" +CuCl2 + 4H2O 。(2)①分液漏斗,,氢氧化钠或碱石灰②BDADC③实验结束时,应首先停止从a中滴加液体,没有必要有多余的氨气制备出。④(18m-16n)y/nx。(3)F铁,或者是铁和三氧化二铁
本题解析:(1)根据化合价升降法进行配平,可得4CuO + 2NH4Cl="3Cu" +CuCl2 + 4H2O 。(2)①仪器a的名称为分液漏斗,仪器b中装人的试剂可以是氢氧化钠或碱石灰,通过吸收水有利于制备出氨气。②从发生装置中出来的氨气带有水份,必须要进行干燥,故B接D,D接A,吸收反应生成的水要用D装置,最后空气中的水不能进入到D中,故要用到C。③实验结束时,应首先停止从a中滴加液体,没有必要有多余的氨气制备出。④由MXOY? ---Y H2O 关系,求得M的相对原子质量为(18m-16n)y/nx。(3)若金属氧化物MxOy为Fe2O3,将反应后固体溶于稀硫酸,然后滴加KSCN溶液没发生明显变化。说明溶液中没有三价铁离子,反应后的固体成分可能全是铁,或者是铁和三氧化二铁,因为Fe +2 Fe3+ = 3Fe2+。
本题难度:一般
4、填空题 (15分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含?mg FeSO4·7H2O的片剂。
(2)某同学为了检验家中的一瓶补铁药(成分为FeSO4)是否变质,查阅了有关资料,得知Fe2+能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,并结合已学的知识设计了如下实验:将药片除去糖衣研细后,溶解过滤,取滤液分别加入两支试管中,在一支试管中滴入酸性高锰酸钾溶液,在另一支试管中滴入KSCN溶液。该同学观察到的现象是:滴入酸性高锰酸钾溶液后褪色,滴入KSCN溶液后不变红,据此得出的结论是?。
(3)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为
3FeS2+8O2 6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移?mol电子。
6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移?mol电子。
(4)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为?;
(5)与明矾相似,硫酸铁也可用作净水剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是?。
参考答案:(15分,每空3分)
(1)69.5 mg
(2)没有变质
(3)32
(4)2Fe3+ + Cu = 2Fe2+ + Cu2+
(5)酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体
本题解析:略
本题难度:简单
5、选择题 向1mol炽热的Cu2S通入足量的水蒸气,充分反应后生成2mol H2,则Cu2S应转化为
A.Cu和SO2
B.Cu和S
C.CuO和SO2
D.Cu2O和S
参考答案:A
本题解析:略
本题难度:简单