|
高考化学知识点归纳《盐类水解的原理》练习题(八)
2019-06-25 21:05:12
【 大 中 小】
|
1、选择题 关于下列电解质溶液的说法中,正确的是
A.常温下,10 mL 0.2mol/L NH4NO3溶液与10 mL 0.1mol/L NaOH溶液混合后所得pH=9.6的溶液中:c(NO3-)>c(NH4+)>c(Na+)>c(NH3·H2O)>c(OH-)>c(H+)
B.0.1 mol/LNa2S溶液中:c(Na+) + c(H+) = c(S2-) + c(HS-) + c(OH-)
C.常温下a mL 0.1 mol/L KOH与b mL 0.1 mol/L HCN两溶液混合后pH>7,则一定有a≥b
D.10 mL 0.1mol/L NaCl溶液中离子总数为x,10mL 0.1mol/LCH3COONa溶液中离子总数为y,则x>y
|
参考答案:AD
本题解析:A中物料守恒c(NH4+)+c(NH3·H2O)=c(NO3-)=2c(Na+),电荷守恒c(Na+)+c(NH4+)+c(H+)= c(NO3-)+c(OH-),又知c(OH-)>c(H+),所以c(NH4+)>c(Na+)>c(NH3·H2O),A正确;0.1 mol/LNa2S溶液中:c(Na+) + c(H+) = 2c(S2-) + c(HS-) + c(OH-),B错误;HCN是弱酸,如果a=b则溶液pH>7,如果a<b则有可能溶液pH>7,所以溶液pH>7不一定a≥b,a<b也有可能,C错;NaCl溶液中电荷守恒:c(Na+)+c(H+)= c(Cl-)+c(OH-),则溶液中的离子总数为2[c(Na+)+c(H+)]V,CH3COONa溶液中电荷守恒:c(Na+)+c(H+)= c(CH3COO-)+c(OH-),则溶液中的离子总数为2[c(Na+)+c(H+)]V,又因CH3COONa溶液显碱性,c(OH-)>c(H+),NaCl溶液呈中性,c(OH-)=c(H+),所以NaCl溶液中的c(H+)大于CH3COONa溶液中的c(H+),所以NaCl溶液中离子总数大于CH3COONa溶液中离子总数,D正确。答案选AD。
考点:溶液中离子浓度大小比较
点评:本题属于较难的离子浓度大小的比较,电荷守恒,物料守恒在本题中起到关键的作用。
本题难度:困难
2、填空题
(10分)(1)AgNO3的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ; 实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性,原因是(用离子方程式表示): ________________ 。
把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的 。
参考答案:(10分)(方程式2分,其余1分)
(1)酸,<,Ag++ H2O  AgOH + H+,抑制。 AgOH + H+,抑制。
(2)酸,Al3++3H2O  Al(OH)3+3H+, Al2O3 ; Al(OH)3+3H+, Al2O3 ;
(3)NaOH
本题解析:(1)AgNO3为强酸弱碱盐,水溶液呈酸性,常温时的pH <7,原因是:Ag++ H2O  AgOH + H+,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解。 AgOH + H+,实验室在配制AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解。
(2)氯化铝为强酸弱碱盐,水溶液呈酸性,其原因是:Al3++3H2O  Al(OH)3+3H+,当把把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3; Al(OH)3+3H+,当把把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3;
(3)硫化钠溶液为强碱弱酸盐,水溶液呈碱性,为了防止发生水解,可以加入少量的NaOH
本题难度:一般
3、选择题 常温下有0.1mol·L-1的NaHA溶液,其pH=9,下列说法正确的是( )
A.c(Na+)=c(HA-)+c(A2-)+c(H2A)
B.c(HA-)>c(Na+)>c(OH-)>c(H+)
C.c(Na+)>c(HA-)>c(OH-)>c(H2A)
D.c(H+)+2c(H2A)= c(OH-) +c(A2-)
参考答案:AC
本题解析:由于NaHA=Na++HA-,H2O H++OH—,HA-+H2O H++OH—,HA-+H2O H2A+OH—,HA- H2A+OH—,HA- H++A2—,则平衡时溶液中的HA-、H2A、A2—均来自原料中的NaHA,根据物料守恒原理可得:c(Na+)=c(HA-)+c(A2-)+c(H2A),故A选项正确;由于溶液的pH=9,说明该盐是强碱弱酸盐,Na+不能水解,HA-既能微弱地水解,也能微弱的电离,且水解程度大于其电离程度,因此平衡时溶液中c(Na+)>c(HA-)>c(OH-)>c(H+),故B选项错误;由于盐电离出的HA-具有两性,则水电离出的氢离子部分与HA-反应生成H2A,即H++ HA-=H2A,该反应中H2A与H+的系数之比等于浓度之比,则被消耗的氢离子浓度等于生成的H2A的浓度,即c(H+)水= c(H+)+c(H2A),而水电离出的部分氢氧根离子与HA-中和生成水和A2—,即OH—+HA-= A2—+H2O,该反应中A2—与OH—的系数之比等于浓度之比,则被消耗的氢氧根离子浓度等于生成的A2—的浓度,即c(OH-)水= c(OH-)+c(A2—),由于水电离出的氢离子等于水电离出的氢氧根离子,则平衡时溶液中c(H+)+c(H2A)=c(OH-)+c(A2—),故D选项错误;由于溶液的pH=9,则c(H+)=10—9mol/L,由于常温下水的离子积为1.0×10—14,c(OH-)=Kw/ c(H+)=10—5mol/L,则c(H+)< c(OH-),由于HA-的水解程度大于其电离程度,则其水解产物浓度大于电离产物浓度,则c(H2A)> c(A2—),由于质子守恒关系式为c(H+)+c(H2A)=c(OH-)+c(A2—),则c(H2A)<c(OH-),由于钠离子不能水解,HA-既能微弱地水解,也能微弱的电离,则c(Na+)>c(HA-)>c(OH-)>c(H2A),故C选项正确。 H++A2—,则平衡时溶液中的HA-、H2A、A2—均来自原料中的NaHA,根据物料守恒原理可得:c(Na+)=c(HA-)+c(A2-)+c(H2A),故A选项正确;由于溶液的pH=9,说明该盐是强碱弱酸盐,Na+不能水解,HA-既能微弱地水解,也能微弱的电离,且水解程度大于其电离程度,因此平衡时溶液中c(Na+)>c(HA-)>c(OH-)>c(H+),故B选项错误;由于盐电离出的HA-具有两性,则水电离出的氢离子部分与HA-反应生成H2A,即H++ HA-=H2A,该反应中H2A与H+的系数之比等于浓度之比,则被消耗的氢离子浓度等于生成的H2A的浓度,即c(H+)水= c(H+)+c(H2A),而水电离出的部分氢氧根离子与HA-中和生成水和A2—,即OH—+HA-= A2—+H2O,该反应中A2—与OH—的系数之比等于浓度之比,则被消耗的氢氧根离子浓度等于生成的A2—的浓度,即c(OH-)水= c(OH-)+c(A2—),由于水电离出的氢离子等于水电离出的氢氧根离子,则平衡时溶液中c(H+)+c(H2A)=c(OH-)+c(A2—),故D选项错误;由于溶液的pH=9,则c(H+)=10—9mol/L,由于常温下水的离子积为1.0×10—14,c(OH-)=Kw/ c(H+)=10—5mol/L,则c(H+)< c(OH-),由于HA-的水解程度大于其电离程度,则其水解产物浓度大于电离产物浓度,则c(H2A)> c(A2—),由于质子守恒关系式为c(H+)+c(H2A)=c(OH-)+c(A2—),则c(H2A)<c(OH-),由于钠离子不能水解,HA-既能微弱地水解,也能微弱的电离,则c(Na+)>c(HA-)>c(OH-)>c(H2A),故C选项正确。
考点:考查考生对溶液pH的了解;考查考生对水的电离和离子积常数的了解;考查考生对盐在水中的水解平衡的了解;考查考生对水溶液中离子浓度大小的比较;考生对物料守恒原理、质子守恒原理的了解。
本题难度:困难
4、选择题 某有机化合物结构式为:
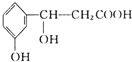
,它可以发生的反应类型有( )
①取代②加成③消去④水解⑤酯化⑥中和⑦缩聚⑧加聚.
A.①③⑤⑥
B.②④⑥⑧?
C.①②③⑤⑥
D.除④⑧外?
参考答案:D
本题解析:
本题难度:一般
5、选择题 在水中加入下列物质,可使水的电离平衡正向移动,且所得溶液呈酸性的是
A.NaCl
B.H2SO4
C.Na2CO3
D.NH4Cl
参考答案:D
本题解析:
本题难度:一般
|