| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《盐类水解的原理》练习题(十)
参考答案:C 本题解析:A.25℃时,pH=7的NH4Cl与NH3·H2O混合溶液,根据电荷守恒可得:c(H+)+ c(NH 本题难度:困难 4、选择题 12.下列盐溶液蒸干后并灼烧,能得到原溶质的是 |
参考答案:A
本题解析:加热时Al3+虽然水解,但硫酸难挥发,最后固体仍为Al2(SO4)3;镁离子会发生水解反应,生成氢氧化镁,而加热可以促进水解,所以最终主要生成的是氢氧化镁,再灼烧就分解成为氧化镁;还原性盐在蒸干时会被O2氧化FeSO4(aq) Fe2(SO4)3(aq); 蒸干NaClO溶液时,既要考虑ClO- 水解,又要考虑HClO分解,所以蒸干NaClO溶液所得固体为NaCl。
Fe2(SO4)3(aq); 蒸干NaClO溶液时,既要考虑ClO- 水解,又要考虑HClO分解,所以蒸干NaClO溶液所得固体为NaCl。
考点:盐类的水解
点评:盐溶液蒸干、灼烧时所得产物的判断:
(1)盐溶液水解生成难挥发性酸时,蒸干后一般得到原物质,如CuSO4(aq) CuSO4(s)。盐溶液水解生成易挥发性酸时,蒸干、灼烧后一般得对应的氧化物,如AlCl3(aq)
CuSO4(s)。盐溶液水解生成易挥发性酸时,蒸干、灼烧后一般得对应的氧化物,如AlCl3(aq)  Al(OH)3
Al(OH)3
本题难度:一般
5、填空题 现有浓度均为0.1mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水,请回答下列问题:
(1)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)____________。
(2)④、⑤、⑥、⑦四种溶液中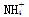 浓度由大到小的顺序是(填序号)________。
浓度由大到小的顺序是(填序号)________。
(3)将③和④按体积比1
参考答案:
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《化学反应速.. | |