1、选择题 下列叙述正确的是
[? ]
A.生成物总能量一定低于反应物总能量
B.放热反应速率总是大于吸热反应速率
C.形成离子键的阴、阳离子间只存在静电吸引力
D.元素周期律是元素原子核外电子排布周期性变化的结果
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列变化属于吸热反应的是
[? ]
①液态水汽化 ②将胆矾加热成白色粉末 ③浓硫酸稀 释④氯酸钾分解制氧气⑤氧化钠溶于水
A.①④
B.②③
C.①④⑤
D.②④
参考答案:D
本题解析:
本题难度:简单
3、简答题 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应 2SO2(g)+O2(g)AUTOTEXT<=>*MERGEFORMAT 错误!未找到引用源.2SO3(g)过程中的能量变化如图所示,回答下列问题.
(1)T℃时将3molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应.2min时反应达到平衡,此时测得反应物O2还剩余0.1mol,则达到平衡时SO2的转化率为?.
(2)下列叙述能证明该反应已达化学平衡状态的是?(填序号)
①SO2的体积分数不再发生变化?②容器内压强不再发生变化?③容器内气体分子总数不再发生变化?④相同时间内消耗2n?molSO2的同时生成n?molO2?⑤相同时间内消耗2n?molSO2的同时生成2n?molSO3
(3)反应?(填“放出”或“吸收”)?热量(用E1、E2或E3表示).

(4)若以右图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应.写出两电极的电极反应式:?;?.为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为?.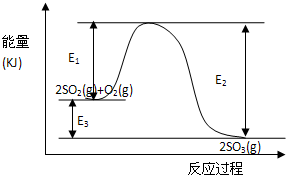
参考答案:(1)2SO2(g)+O2(g)?2SO3(g)?
? 开始?3 mol? 1mol? 0?
?转化?1.8 mol?0.9mol? 1.8 mol?
?平衡?1.2mol?0.1mol? 1.8 mol?
? 所以SO2的转化率=1.8mol3mol×100%=60%
故答案为:60%
(2)该反应前后气体体积减小,化学平衡状态的标志:正逆反应速率相等(同种物质)或正逆速率之比等于化学计量数之比(不同物质),反应混合物各组分的浓度不变、物质的量不变、含量为定值.
①②③④符合条件;⑤所指方向一致,故⑤错.
故选:①②④
(3)从图象知,反应物的能量大于生成物的能量,所以该反应是放热反应;
?根据能量守恒放出的热量为E3?或E2-E1.
故答案为:放热;E3?或E2-E1
(4)该原电池的本质是2SO2+O2+2H2O=2H2SO4,SO2在负极上发生氧化反应电极反应式为SO2-2e-+2H2O═SO42-+4H+,O2在正极上发生还原反应电极反应式为O2+4e-+4H+═2H2O;
为维持浓度不变,SO2和O2、H2O反应生成硫酸的质量分数是50%,所需的水为反应的水和做溶剂的水,所以质量比为=2×64:(2×18+2×98)=16:29
故答案为:正极:O2+4e-+4H+═2H2O,负极:SO2-2e-+2H2O═SO42-+4H+; 16:29
本题解析:
本题难度:一般
4、选择题 2012年6月16日18时37分,我国在酒泉卫星发射中心用长征二号F运载火箭,成功发射神舟九号飞船.火箭所需要的巨大能量由特制的燃料来提供,有关燃料燃烧过程中的变化,下列说法不正确的是( )
A.所有的燃烧过程均是放热的
B.需要点燃才能发生的燃烧过程是吸热的
C.所有燃料在燃烧过程中均会发生化学键的断裂
D.燃烧后产物的总能量一定小于反应物的总能量
参考答案:A、燃烧为发光、放热、剧烈的氧化还原反应,所有的燃烧过程均是放热反应,故A正确;
B、大多物质燃烧需要点燃才能反应,燃烧是放热反应,故B错误;
C、燃烧是化学变化,反应过程中一定有化学键的断裂和形成,所以所有的燃料在燃烧过程中均会发生化学键的断裂,故C正确;
D、燃烧是放热反应,依据能量守恒,燃烧后产物的总能量一定小于反应物的总能量,故D正确;
故选:B.
本题解析:
本题难度:一般
5、选择题 下列说法正确的
[ ? ]
A.需加热才能发生的反应一定是吸热反应? ?
B.放热的反应在常温下一定易进行 ?
C.反应是放热还是吸热是由反应物和生成物所具有的能量的相对大小决定的 ?
D.质量数相同的原子,其化学性质也一定相同
参考答案:C
本题解析:
本题难度:简单