| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《原电池原理》典型例题(八)
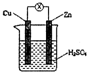 参考答案:A、原电池反应是锌和稀硫酸反应生成硫酸锌和氢气,无铜离子生成,故A错误; 本题解析: 本题难度:一般 2、简答题 (1)某化学兴趣小组通过实验来实现电能转化成化学能,他们在U形管中加入适量饱和氯化铜溶液,用石墨棒作电极,接通直流电源开始实验. 参考答案:(1)①用石墨棒作电极电解饱和氯化铜溶液,与电源正极相连的是阳极,是氯离子失电子发生氧化反应生成氯气电解 反应为:2Cl--2e-═Cl2↑;检验氯气的方法是用湿润的淀粉碘化钾试纸放在该电极附近变蓝,证明生成的是氯气, 本题解析: 本题难度:一般 3、选择题 锌锰干电池在放电时,电池总反应方程式可表示为:Zn+2MnO2+2NH4+=Zn 2++ Mn2O3+2NH3+H2O在电池放电时,正极(碳棒)上发生反应的物质是 |
参考答案:C
本题解析:电池总反应方程式可表示为:Zn+2MnO2+2NH4+=Zn 2++ Mn2O3+2NH3+H2O可知该反应锌失电子作负极,正极MnO2的电子化合价降低:2MnO2+2NH4++2e-= Mn2O3+2NH3+H2O,故C项正确。
考点:电化学电极反应。
本题难度:一般
4、选择题 化学平衡常数(K)、弱酸的电离平衡常数(Ka)、难溶物的溶度积常数(KSP)是判断物质性质或变化的重要的平衡常数。下列关于这些常数的说法中,正确的是
A.平衡常数的大小与温度、浓度、压强、催化剂等有关
B.当温度升高时,弱酸的电离平衡常数Ka变小
C.KSP(AgCl) > KSP(AgI) ,由此可以判断AgCl(s) + I-(aq)= AgI(s)+ Cl-(aq)能够发生
D.Ka(HCN) < Ka(CH3COOH) ,说明物质的量浓度相同时,氢氰酸的酸性比醋酸强
参考答案:C
本题解析:平衡常数的大小与温度有关系,选项A不正确;电离是吸热的,加热促进电离,电离常数增大,选项B不正确;酸的电离常数越小,说明酸性越弱,因此选项D不正确,所以正确的答案选C。
本题难度:一般
5、填空题 依据氧化还原反应:2Ag+(aq) +Cu(s)=Cu2+(aq) +2Ag(s)设计的原电池如图所示。请回答下列问题:? 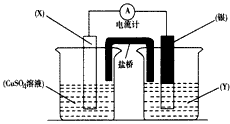
(1)电极X的材料是___________;电解质溶液Y是____________;
(2)银电极为电池的________极,发生的电极反应为______________;x电极上发生的电极反应为
______________
(3)外电路中的电子是从____电极流向____电极。
参考答案:(1)铜;AgNO3溶液?
(2)正;Ag++e-==Ag;Cu-2e-=Cu2+
(3)铜;银
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《物质的量》.. | |