1、选择题 下列说法错误的是( )
A.碱性锌锰干电池的负极反应式为:Zn+2OH--2e-=ZnO+H2O
B.化工厂中常采用阴极电保护法防止盛装酸性溶液的容器发生腐蚀
C.在电镀槽中,镀件做阴极,阳极可以选用惰性材料或者镀层金属
D.用惰性电极电解某硫酸铜溶液一段时间后.要恢复溶液的成分和浓度,可向溶液中加入一定量的氧化铜或氢氧化铜
参考答案:A.碱性锌锰干电池中,锌易失电子而作负极,负极反应式为:Zn+2OH--2e-=ZnO+H2O,故A正确;
B.电解池中阴极上阳离子得电子发生还原反应,所以阴极金属被保护,故B正确;
C.电镀时,镀层或惰性电极作阳极,镀件作阴极,镀件上得电子而析出镀层金属,故C正确;
D.用惰性电极电解某硫酸铜溶液时,阳极上析出氧气,阴极上析出铜,要恢复溶液的成分和浓度,可向溶液中加入一定量的氧化铜或碳酸铜,故D错误;
故选D.
本题解析:
本题难度:简单
2、选择题 下列叙述不正确的是( )
A.纯银器表面在空气中因化学腐蚀渐渐变暗
B.氢氧燃料电池是一种将热能转化为电能的装置
C.可将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀
D.电解饱和食盐水的阳极反应为:2Cl--2e-=Cl2↑
参考答案:A、金属银易被空气中的氧气氧化生成氧化银,纯银器表面在空气中因化学腐蚀渐渐变暗,故A正确;
B、燃料电池属于原电池,原电池是将化学能转化为装化为电能的装置,故B错误;
C、在电解池中,做阴极的金属被保护,不易被腐蚀,如将地下输油钢管与外加直流电源的负极相连以保护它不受腐蚀,故C正确;
D、电解饱和食盐水时,阳极是氯离子发生失电子的氧化反应,即2Cl--2e-=Cl2↑,故D正确.
故选B.
本题解析:
本题难度:简单
3、填空题 如图所示原电池装置,回答下列问题:
(1)此电池的负极是:______,正极的电极反应式是:______.
(2)该电池工作一段时间后,装置中出现的现象是______,
将银电极小心取出洗涤并晾干,经称量发现比原来增重了5.4g.则导线中通过的电子的物质的量为______.
参考答案:(1)Cu比Ag活泼,做原电池的负极,Ag为原电池的正极,发生还原反应,电极反应为Ag++e-=Ag,
故答案为:铜或Cu,Ag++e-=Ag;
(2)原电池工作时,负极铜失去电子被氧化生成铜离子,铜的质量逐渐减少,银极上生成银,质量逐渐增大,溶液中生成铜离子,溶液颜色变蓝,
当银电极质量增加5.4g,则n(Ag)=5.4g108g/mol=0.05mol,根据电极反应Ag++e-=Ag,可知导线中通过的电子的物质的量为0.05mol,
故答案为:铜电极变细,银电极变粗,溶液颜色变蓝;0.05mol.
本题解析:
本题难度:一般
4、填空题 (1)将铜棒与锌棒用导线连接,分别插入盛有:①硫酸溶液;②硫酸铜溶液;③硫酸钠溶液的三个烧杯中,此时,铜棒上发生的主要反应是: ①____ ②____, ③____。
(2)铜制品在经常下酸雨的地区电化学腐蚀严重。写出此电化学腐蚀的电极反应式:正极____,负极________。
(3)将表面去掉氧化膜的镁片和铝片用带电流表的导线相连,插入盛有烧碱溶液的烧杯中,此时发现电流计指针偏转,判断此原电池的正负极,并写出电极反应式和总反应式。正极____,电极反应式___;负极____,电极反应式____;总反应式____。
参考答案:(1)①2H++2e-=H2↑? ;②Cu2+ +2e-=Cu ;③O2+2H2O+4e-=4OH-
(2)O2+2H2O+4e-=4OH-? ;Cu-2e-=Cu2+
(3)Mg ;2H2O+2e-=H2↑+2OH-? ;Al? ;Al+4OH-- 3e-=AlO2-+2H2O ;2Al+2NaOH+2H2O=2NaAlO2+ 3H2↑
本题解析:
本题难度:一般
5、选择题 下图为氢氧燃料电池的原理示意图,按照此图的提示,下列叙述中不正确的是( )
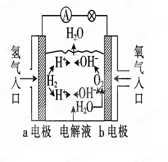
A.a电极是负极
B.b电极的电极反应式为4OH--4e-=2H2O+O2↑
C.在电池内部,H+向b电极附近运动
D.氢氧燃料电池是一种具有广泛应用前景的绿色电源