1、简答题 汽车尾气中的NO,是造成大气污染的物质之一,但NO又是工业生产硝酸的中间产物,另外NO在人体的血管系统内又有传送信息的功能,有三位教授因此项研究成果而获得1998年诺贝尔奖.
(1)汽车尾气中NO的来源是______.
A.汽油、柴油中含氮,是其燃烧产物
B.是空气中的N2与汽油、柴油的反应产物
C.是空气中的N2与O2在汽车气缸内的高温环境下的反应产物
D.是汽车高温尾气导致了空气中N2与O2的化合反应
(2)写出NO造成酸雨的两个化学反应方程式______.
(3)在汽车尾气排放管中安装一个“催化转换器”(用铂、钯合金作催化剂),可将尾气中另一种有害气体CO跟NO反应转化为无毒气体,并促使汽油、柴油等物质充分燃烧及SO2的转化.
①写出CO与NO反应的化学方程式:______.
②“催化转化器”的缺点是在一定程度上提高了空气的酸度,其原因是______.
(4)控制或者减少城市汽车尾气污染的方法可以有______.
A.开发氢能源B.使用电动车
C.使用含铅汽油?D.严禁车辆行驶.
参考答案:(1)汽车尾气中NO的来源于空气中的N2与O2在汽车气缸内的高温环境下的反应产物NO,故选:C;
(2)硝酸型酸雨的形成过程:一氧化氮在空气中会与氧气反应,生成二氧化氮,二氧化氮有与空气中的水反应,生成了硝酸和一氧化氮,故答案为:2NO+O2=2NO2;3NO2+H2O=2HNO3+NO;
(3)①因CO跟NO反应转化为无毒气体,从CO、NO的化合价分析,可以猜测出“无毒气体”的成分是N2和CO2;
故答案为:2CO+2NO?催化剂?.?2CO2+N2;
②由于“催化转化器”促进了SO2的转化,生成的SO3增多,SO3+H2O=H2SO4,提高了空气的酸度.
故答案为:SO2转化为SO3,产生了硫酸酸雾;
(4)因使用清洁能源和不使用产生污染的能源可减少城市汽车尾气污染,严禁车辆行驶是不切实际,使用含铅汽油会产生污染,故答案为:A、B.
本题解析:
本题难度:一般
2、简答题 解放日报2004年10月14日报道:德国科学家日前利用卫星数据和一种先进的仪器,绘制了一幅地球上空二氧化氮的分布图,从科学家绘制的二氧化氮分布图看,欧洲和北美洲的一些大城市上空二氧化氮密度很高,其原因是( )
A.这些地区的硝酸工厂多
B.这些地区的人口少
C.这些地区的绿化面积少
D.这些地区的机动车辆过多
参考答案:机动车(汽车等)在启动“打火”过程中使大气中N2、O2生成NOx,氮氧化物有毒,能污染空气,所以能引起污染,则汽车过多是大城市形成大气污染不可忽视的因素,故选D.
本题解析:
本题难度:一般
3、选择题 同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和
O2,③NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、
V3,则下列关系正确的是
[? ]
A.V1>V2>V3
B.V1>V3>V2
C.V2>V3>V1
D.V3>V1>V2
参考答案:B
本题解析:
本题难度:一般
4、选择题 最新的研究表明:一氧化氮吸入治疗法可快速改善SARS中重症患者的缺氧状况,缓解病情.病毒学研究证实,一氧化氮对SARS病毒有直接抑制作用.下列关于一氧化氮的叙述正确的是( )
A.一氧化氮是一种红棕色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化合
C.含等质量氧元素的一氧化氮与一氧化碳的物质的量相等
D.一氧化氮易溶于水,不能用排水法收集
参考答案:C
本题解析:
本题难度:简单
5、简答题 氮及其化合物在工农业生产中具有重要作用.
(1)某小组进行工业合成氨N2(g)+3H2(g)?2NH3(g)△H<0的模拟研究,在1L密闭容器中,分别加入0.1molN2和0.3molH2.实验①、②、③中c(N2)随时间(t)的变化如图所示.
实验②从开始到达到平衡状态的过程中,用H2表示的平均反应速率为______.
与实验①相比.实验②所采用的实验条件可能为______(填字母),实验③所采用的实验条件可能为______(填字母).
a.增大压强b.减小压强c.升高温度d.降低温度e.使用催化剂
(2)NH3可用于处理废气中的氮氧化物,其反应原理为2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H<O,
欲提高废气中氮氧化物的转化率,可采取的措施是______(填字母)
a.升高温度b.增大压强c.增大NH3的浓度
(3)NCl3遇水发生水解反应,生成NH3的同时得到______(填化学式).ClO2是广谱高效消毒剂,制备原理为NCl3+6ClO2-+3H2O=NH3↑+6ClO2+3OH-+3Cl-.若转移1mol电子,则制取ClO2的质量为______.
(4)25℃时,将amol?L-1的氨水与bmol?L-1盐酸等体积混合,反应后溶液恰好显中性,则a______b(填“>”、“<”或“=”).用a、b表示NH3?H2O的电离平衡常数为______.
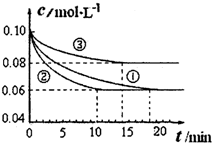
参考答案:(1)由图可知,实验②10min到达平衡,平衡时△(N2)=0.1mol/L-0.06mol/L=0.04mol/L,由方程式可知,△c(H2)=3△(N2)=3×0.04mol/L=0.12mol/L,故v(H2)=0.12mol/L10min=0.012mol/(L?min),
由图可知,与实验①相比,实验②到达平衡所以时间较短,反应速率较快,但平衡时氮气的浓度不变,改变条件平衡不移动,该反应正反应是气体体积减小的反应,增大压强平衡会移动,故实验②应是使用催化剂,
由图可知,与实验①相比,实验③到达平衡所以时间较短,反应速率较快,平衡时氮气的浓度增大,改变条件平衡逆向移动,该反应正反应是体积减小的放热反应,故为升高温度;
故答案为:0.012mol/(L?min),e,c;
(2)提高废气中氮氧化物的转化率,应改变条件使平衡向正反应移动,
a.该反应正反应是放热反应,升高温度,平衡向逆反应移动,氮氧化物的转化率降低,故a错误;
b.该反应正反应是体积增大的反应,增大压强,平衡向逆反应移动,氮氧化物的转化率降低,故b错误;
c.增大NH3的浓度,平衡向正反应移动,氮氧化物的转化率增大,故c正确;
故答案为:c;
(3)NCl3遇水发生水解反应,NCl3分子中负价原子结合水电离的氢离子,正价原子结合水电离的去氢根离子,故生成NH3的同时还得到HClO,
反应中只有氯元素的化合价发生变化,氯元素由NCl3中+1降低为Cl-中-1价,由ClO2-中+3价升高为ClO2中+4价,故转移1mol电子,生成ClO2的物质的量为1mol,质量为1mol×67.5g/mol=67.5g,
故答案为:HClO,67.5;
(4)溶液显中性,所以c(H+)=c(OH-),溶液的电荷守恒可得:c(H+)+c(NH4+)=c(Cl-)+c(OH-),故c(NH4+)=c(Cl-),氯化铵是强酸弱碱盐其水溶液呈酸性,要使氯化铵溶液呈中性,则氨水应稍微过量,因为盐酸和氨水的体积相等,则氨水的物质的量浓度大于盐酸,
溶液中c(H+)=c(OH-)=10-7mol/L,c(NH4+)=c(Cl-)=b2mol/L,c(NH3?H2O)=(a2-b2)mol/L,
电离常数只与温度有关,则此时NH3?H2O的电离常数Kb=c(NH+4)?c(OH-)c(NH3?H2O)=b2×10-7a2-b2=b×10-7a-b,
故答案为:>,b×10-7a-b.
本题解析:
本题难度:一般