1、选择题 过量的河砂、纯碱和生石灰熔化后生成( )
①水泥;②玻璃;③瓷器;④混凝土;⑤一种硅酸盐产品.
A.①④
B.②⑤
C.③
D.②④
参考答案:B
本题解析:
本题难度:一般
2、选择题 化学是一门实用科学,生活中处处有化学。下列说法正确的是
[? ]
A.硅是光纤制品的基本原料
B.玻璃、水泥、金刚砂是硅酸盐产品
C.漂白粉的有效成分是CaCl2
D.硅胶可用作瓶装药品干燥剂
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列叙述正确的是?
A.提出原子结构模型的科学家按时间先后依次是:道尔顿、卢瑟福、汤姆生、玻尔
B.氯气是瑞典化学家舍勒发现的
C.海水中含有丰富的碘元素,因此碘被称为“海洋元素”
D.溴化银可用于人工降雨
参考答案:B
本题解析:A:顺序依次为:道尔顿、汤姆生、卢瑟福、玻尔
B:正确
C:溴为海洋元素
D:碘化银常用于人工降雨
故答案为B
本题难度:简单
4、填空题 (16分)蛇纹石因其花纹似蛇皮而得名,某地蛇纹石大约含MgO38%,另外除了含SiO2外,还含有CaO、Fe2O3、Al2O3等氧化物,由蛇纹石矿制备MgO的工艺流程如下。
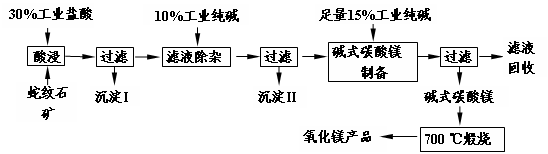
(1)写出酸浸过程中的一个离子方程式?。若在实验室进行酸浸过程,需要的仪器有烧杯、?。
(2)沉淀I的成分是?(写化学式)。写出它的一个用途?。
(3)沉淀II的成分是?。
(4)从滤液中能回收的物质有?。
(5)写出碱式碳酸镁700 ℃煅烧产生氧化镁的化学方程式?。
参考答案:(1)MgO+2H+=Mg2++H2O;或CaO+2H+=Ca2++H2O;或Fe2O3+6H+=2Fe3++3H2O;
或Al2O3+6H+=2Al3++3H2O(任写一个,2分)?
玻璃棒?(2分)
(2)SiO2?制取(水)玻璃、光纤等(各2分)?
(3)CaCO3、Fe(OH)3、Al(OH)3;或Ca、Fe、Al等的碱或碳酸盐沉淀(3分)?
(4)NaCl、Na2CO3、NaHCO3(各1分,共3分)?
(5)Mg2(OH)2CO3 2MgO+CO2↑+H2O↑
2MgO+CO2↑+H2O↑
或aMgCO3·bMg(OH)2 (a+b)MgO+aCO2↑+bH2O↑(2分)
(a+b)MgO+aCO2↑+bH2O↑(2分)
本题解析:(1)根据矿石中的成分可知只有SiO2和盐酸不反应,其它氧化物均和盐酸反应。为了加快反应的进行,在反应过程中需要用玻璃棒不断的搅拌。
(2)SiO2不溶于水,通过过滤即得到。二氧化硅的主要用途是制造光导纤维或制取玻璃等。
(3)滤液中的金属阳离子有Mg2+、Ca2+、Fe3+、Al3+,加入过量的纯碱Na2CO3可以生成CaCO3、Fe(OH)3、Al(OH)3沉淀。
(4)当把碱式碳酸镁过滤之和,根据原子守恒可知滤液中的主要物质是氯化钠、碳酸钠和碳酸氢钠。
(5)碱式碳酸镁在加热的条件下分解生成氧化镁、CO2和水。
本题难度:一般
5、选择题 工业上冶炼金属铝,经常采用的方法是
A.电解法
B.热分解法
C.热还原法
D.热氧化法
参考答案:A
本题解析:铝是活泼的金属,冶炼的方法是电解熔融的氧化铝,答案选A。
点评:该题是常识性知识的考查,难度不大。该题的关键是明确金属冶炼的原理和方法,即金属的冶炼一般是依据金属的活泼性选择相应的方法,常见金属冶炼的方法有:1.热分解法:适用于不活泼的金属,如汞可用氧化汞加热制得;2.热还原法:用还原剂(氢气,焦炭,一氧化碳,活泼金属等)还原;3.电解法:适用于K、Ca、Na、Mg、Al等活泼金属;4.其他方法:如CuSO4+Fe=Cu+FeSO4。
本题难度:简单