1、填空题 三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:

(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因???,如何用简单方法判断其已洗涤干净??。
(2)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,适宜的加热方式是?。

(3)用上图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通入氮气,使CCl4蒸气经氮气载入反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度
控制在50~60℃之间;④反应管出口端出现了CrCl3升华物
时,切断加热管式炉的电源;⑤停止加热CCl4,继续通人氮气;⑥检查装置气密性。正确的顺序为:⑥→③→??。
(4)已知反应管中发生的主要反应有:Cr2O3 + 3CCl4 → 2CrCl3 + 3COCl2,因光气剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为???。
(5)样品中三氯化铬质量分数的测定
称取样品0.3300g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O72-存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2===Na2S4O6+2NaI。
①该实验可选用的指示剂名称为???。
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是??。
③样品中无水三氯化铬的质量分数为???。
参考答案:

本题解析:略
本题难度:一般
2、选择题 硅是带来人类文明的重要元素之一.下列物质中主要成分是硅酸盐的是( )
A.陶瓷
B.金刚石
C.水晶
D.大理石
参考答案:A
本题解析:
本题难度:简单
3、填空题 利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生产铁红和补血剂乳酸亚铁。其生产步骤如下:
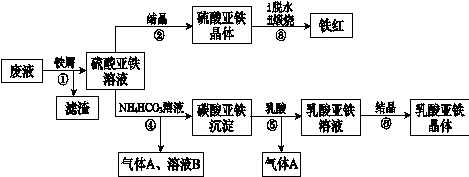
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42—。请回答:
(1)步骤①中分离硫酸亚铁溶液和滤渣的操作中所用的玻璃仪器是???。
步骤②得到硫酸亚铁晶体的操作为蒸发浓缩、????。
(1)步骤④的离子方程式是?。
(1)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及???。
(1)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为???。
(1)用平衡移动的原理解释步骤⑤中加乳酸能得到乳酸亚铁的原因?。
(1)为测定步骤②中所得晶体中FeSO4·7H2O的质量分数,取晶体样品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(杂质与KMnO4不反应)。若消耗0.1000 mol?L-1 KMnO4溶液20.00 m L,所得晶体中FeSO4·7H2O的质量分数为(用a表示)?。
参考答案:
(1)玻璃棒、烧杯、漏斗?(1分) ;冷却结晶、过滤、洗涤、干燥(1分)
(1)Fe2++2HCO3-=FeCO3↓+H2O+CO2↑(2分)?
(1)防止Fe2+被氧化(1分)?
(1)1: 4?(2分) ?
(1)FeCO3(s)  ?Fe2+(aq)+ CO32-(aq)? CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液(2分)?
?Fe2+(aq)+ CO32-(aq)? CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液(2分)?
(1)13.9/a ×100%(2分)
本题解析:
(1)过滤用的仪器:玻璃棒、烧杯、漏斗?;“冷却结晶、过滤、洗涤、干燥”从溶液变成纯固体。
“冷却结晶、过滤、洗涤、干燥”从溶液变成纯固体。
(2)Fe2++2HCO3-→FeCO3↓+H2O+CO2↑?
(3)隔绝空气,防止Fe2+被氧化 。?
(4)4FeSO4+ O2 =4SO3? + 2 Fe2O3?氧化剂O2和还原剂FeSO4的物质的量之比? 1: 4?。?
(6)FeSO4和KMnO4反应的关系式 解:设20.00 mL溶液含FeSO4的物质的量为x
10FeSO4·7H2O ——2 KMnO4
2
x?0.1000*20.00/1000? x=0.01
100 mL FeSO4·7H2O的物质的量为0.01*5=0.05 (mol)
FeSO4·7H2O的质量分数为278*0.05*100%/a=13.9/a ×100%
本题难度:困难
4、选择题 下列冶炼金属的化学原理错误的是
A.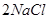 (熔融)
(熔融)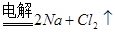
B.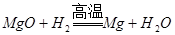
C.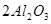 (熔融)
(熔融)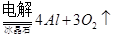
D.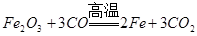
参考答案:B
本题解析:金属的冶炼一般是根据金属性强弱来选择,一般金属性越强的金属用电解法,不活泼的金属用热分解法,处于中间的金属用还原剂还原。镁是活泼的金属,用电解法冶炼,B是不正确,其余都是正确的,答案选B。
本题难度:简单
5、填空题 古希腊流传这样一个传奇故事。一批运纯碱的商船停泊在江边的沙岸旁,商人找不到石头来搭灶煮饭,就把船上的大块纯碱搬来,放在沙地上垫锅做饭,饭熟后商人们惊奇地发现“灶”变成了晶莹透明的固体。这固体是__________。主要成分是___________________。
参考答案:玻璃;Na2SiO3和SiO2
本题解析:
本题难度:一般