1、实验题 (12分)某学业生利用以下装置制备氨气,并完成氨气的喷泉实验。

请回答下列问题:
(1)装置A中发生反应的化学方程式?。
(2)装置B中所盛的试剂是?。
(3)如果将制备氨气和氨气喷泉组合为一整套实验,用字母表示接口的连接顺序:
(?)、(?)、C、(?)(?)(?)(?)(?)
(4)组装好装置,检查装置的气密性后,加入试剂关闭K3,打开K1?、K2给A装置试管进行加热。当?(填写现象)时,即烧瓶中氨气收满。
(5)装置E的作用?。
(6)请叙述引发该喷泉实验的操作过程?。
参考答案:
(1)2NH4Cl+Ca(OH)2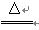 CaCl2+2NH2↑+2H2O(2分)
CaCl2+2NH2↑+2H2O(2分)
(2)碱石灰(2分)
(3)a、b、h、I、d、e、f(2分)(错一个空该项为0分)(h与I可对调)
(4)D中的酚酞溶液变红(2分)
(5)储存氨气、调节装置中的压强起到安全作用(2分)
(6)打开K3,关闭K1、K2用手握住(或用热、冷毛巾握住)圆底烧瓶,一会儿,松开手,即可引发喷泉(2分)
本题解析:略
本题难度:一般
2、选择题 下列制备物质的设计中,理论上正确、操作上可行、经济上合理的是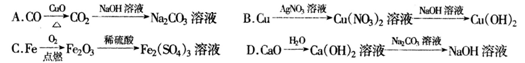
参考答案:D
本题解析:
A选项中的第一步操作较难控制,C的利用率低,且生成的CO污染大气,不可选;B选项中的AgNO3是一种比较昂贵的药品,该制备流程经济效益差;C项中Fe点燃生成的是Fe3O4,得不到纯净的Fe2(SO4)3溶液。Ca(OH)2微溶,溶解的Ca(OH)2都变成CaCO3沉淀了,于是,更多的Ca(OH)2溶解,接着沉淀,然后又溶,。。。最后,所有的Ca(OH)2都溶解了,当然也就都变成当然也就只有NaOH了,故D可以。
本题难度:一般
3、实验题 (10分)为了比较卤素单质的氧化性强弱,可在实验室先制取Cl2(利用MnO2与浓盐酸反应可制取Cl2),并将Cl2依次通入NaBr溶液和KI-淀粉溶液中。如图所示仪器及药品,试回答:

(1)若所制取气体从左向右流向时,上述仪器接口的连接顺序为________接________、________接________、________接________、________接________。(填字母)
(2)实验开始后装置5中反应的离子方程式为______________________________。
(3)装置3的作用是__________________________________,反应的离子方程式为_______________________________。
(4)装置1中产生的现象是:溶液先变蓝一段时间后蓝色褪去,生成两种强酸,请写出蓝色褪去的化学方程式:___________________________________________________。
参考答案:(每空2分共10分)(1)F G H D C B A E
(2)MnO2+4H++2Cl—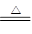 Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(3)吸收未反应完的Cl2,以免污染空气
Cl2+2OH-===Cl-+ClO-+H2O
(4) 5Cl2+I2+6 H2O ===2HIO3+10HCl
本题解析:本题主要考查了氯气的制取、收集、尾气处理及化学性质等内容,属基本知识。具体请见答案
本题难度:简单
4、实验题 (每空2分,共14分)
(一)用碳酸钠粉末配制0.2000 mol·L-1Na2CO3溶液0.5L
(1)需选用的玻璃仪器或用品?(填字母编号)
B、0.5L平底烧瓶? C、0.5L容量瓶? D、0.5L圆底烧瓶? E、烧杯? F、试管? G、胶头滴管? H、量筒? I、托盘天平? J、药匙? M、滤纸? N、玻璃棒
(2)应称取?g 碳酸钠粉末来溶于水
(二)用0.2000 mol·L-1Na2CO3溶液标定未知浓度的盐酸
(1)把0.2000 mol·L-1Na2CO3溶液装入?(酸式,碱式)滴定管中。从此滴定管中放出20. 00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据?判断滴定终点达到。
00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据?判断滴定终点达到。
(2)终点达到时,用去盐酸16.00mL(三次的平均值),则盐酸c(HCl)=?
(三)中和热的测定
用(二)实验中标定好浓度的盐酸50.0mL与0.55mol·L-1NaOH 50.0mL反应做中和热的测定实验。每次用量均一样,三次实验测得温 度升高的平均值为3.41℃,则实验测得中和热△H=?(混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论?(偏高,相等,偏低)
度升高的平均值为3.41℃,则实验测得中和热△H=?(混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论?(偏高,相等,偏低)
参考答案:(每空2分 ,?共14分)
(一)(1)CHENG?(2)10.6
(二)(1)碱式?黄色变成橙色30s不褪去
(2)0.5mol/L
(三)- 57.0 KJ/mol?偏高
本题解析:略
本题难度:简单
5、实验题 (4分)取三份锌粉,分盛于甲、乙、丙三支试管中,分别加入以下物质后,及时塞上导管塞子,充分反应。甲加入50mLpH=2盐酸,乙加入50mL pH=2醋酸,丙加入50mL pH=2醋酸及少量的胆矾粉末。
(1)若反应终了甲和乙中产生氢气的体积一样多,且只有一支试管中金属有剩余,则开始时加入的锌的质量大小关系为?(以上用“甲、乙”和? “>?、 < 、 ="”" 回答)
(2)若反应终了生成氢气的体积一样多,且没有剩余的锌。回答以下问题。
①三支试管中参加反应的锌的质量大小关系为:?
(用“甲、乙、丙”和? “>?、 < 、 ="”" 回答)
②反应终了,所需时间为:? (同①)
③若以上三组实验,锌粉均过量,产生的氢气体积?(同①)
参考答案:(4分)(1)甲>乙? (2)①丙>甲=乙?②甲>乙>丙?③乙=丙>甲
本题解析:(1)醋酸属于弱酸,溶液中的醋酸部分电离,溶液中部分氢离子以醋酸分子的形式存在,所以体积相同,PH相同的醋酸和盐酸,醋酸实际含有的氢离子的物质的量大于盐酸实际含有的氢离子的物质的量,甲和乙两只试管产生氢气的体积一样多,说明醋酸没有反应完全,加入的锌粉不足;只有一支试管中金属有剩余,那么只能是盐酸的试管中金属剩余,如果是醋酸的试管中金属剩余那么产生的气体一定是乙管多,所以开始时加入的锌的质量大小关系为甲>乙。
(2)①反应终了生成氢气的体积一样多,甲和乙中只有锌粉与酸反应,生成的气体一样多根据得失电子守恒可以判断消耗的锌粉也应该一样多,甲=乙;三支试管中锌粉均没有剩余,而丙中含有硫酸铜溶液会与锌粉反应消耗锌粉,所以丙中加入的锌粉比较多,所以加入锌粉的质量大小为丙>甲=乙。②丙中存在硫酸铜,锌粉与其反应生成铜,进而形成原电池,所以反应最快,所需时间最短,乙中随着反应的进行溶液中的醋酸分子电离平衡向电离的方向进行,溶液中的氢离子得到了适当的补充,而甲试管中氢离子不断消耗浓度减小反应速率减小,反应最慢,所需时间最长。所以反应所需的时间为甲>乙>丙,③锌粉过量,三种溶液中的酸均完全反应,乙和丙中酸的含量是相同的所以生成的气体的量也相同,而乙和丙存在没有电离的醋酸分子,随着反应的进行,这一部分醋酸也会电离出氢离子,所以在锌粉过量的情况下生成的气体最多,甲中盐酸是强酸,不存在此过程所以产生的气体较少所以产生气体的顺序是乙=丙>甲。
本题难度:一般