1、选择题 在一集气瓶充入1/2体积H2,1/4体积N2,1/4体积Cl2,光照使之爆炸后,倒置于水槽中,最后进入集气瓶中的水的体积应该是:
A.1/3体积
B.1/4体积
C.1/2体积
D.2/3体积
参考答案:C
本题解析:略
本题难度:一般
2、选择题 下列关于氯的说法正确的是( )
A.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
B.1735Cl、1737Cl为不同的核素,有不同的化学性质
C.实验室制备Cl2,可用排饱和食盐水集气法收集
D.1.12LCl2含有1.7NA个质子(NA表示阿伏伽德罗常数)
参考答案:A、氯有最低化合价-1价,最高化合价+7价,而单质中元素的化合价为0价,在化学反应中既可做氧化剂又可做还原剂,故A错误;
B、同位素具有相同的化学性质,故B错误;
C、氯气难溶于饱和食盐水,实验室制备Cl2,可用排饱和食盐水集气法收集,故C正确;
D、没有说明是在标准状况下,故D错误;
故选C.
本题解析:
本题难度:一般
3、选择题 下列物质中,不能使有色布条褪色的是( )
A.次氯酸钠溶液
B.次氯酸钙溶液
C.新制氯水
D.氯化钙溶液
参考答案:A、因次氯酸钠溶液在漂白时,跟稀酸或二氧化碳的作用,使漂白粉生成次氯酸,次氯酸具有漂白性,所以有色布条会褪色,故A错误;
B、因次氯酸钙溶液在漂白时,跟稀酸或二氧化碳的作用,使漂白粉生成次氯酸,次氯酸具有漂白性,所以有色布条会褪色,故B错误;
C、因氯水的主要成分就是盐酸和次氯酸,因为次氯酸具有漂白性,所以有色布条会褪色,故C错误;
D、因氯化钙溶液中无次氯酸也不会生成次氯酸,所以有色布条不会褪色,故D正确;
故选D.
本题解析:
本题难度:简单
4、填空题 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
(1)装置A的分液漏斗中盛装的试剂是______,烧瓶中加入的试剂是______.
(2)画出虚线框内的实验装置图,并注明所加试剂,______说明装置的作用______.
(3)装置B中盛放的试剂是______(选填下列所给试剂的代码),实验现象为______,化学反应方程式是______,该反应属于四种基本反应类型中的______反应.
A.Na2S溶液?B.Na2SO3溶液?C.Na2SO4溶液
(4)从原子结构的角度简要分析氯元素的非金属性比硫元素的非金属性强的原因.
______
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例).
______
(6)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气.在该反应中,Cl元素的化合价既有升高又有降低,即在反应中Cl元素的原子既能获得电子也能失去电子,能否说氯元素既具有金属性又具有非金属性?简述你的理由.
______
______.
参考答案:(1)为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,则必须用装置A制备氯气,实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中A的分液漏斗中盛装的试剂是浓盐酸,烧瓶中加入的试剂是MnO2.故答案为:浓盐酸;MnO2;
(2)由于用浓盐酸制取氯气,且需要加热,即实验过程中要挥发出HCl气体,因此虚线框部分应是除去HCl气体的装置,可以使用洗气瓶,瓶内盛装饱和食盐水,既除去HCl,又降低氯气在水中的溶解度.所用装置为:
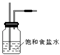
.故答案为:

;除去Cl2中的HCl气体;
(3)要在B中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,化学方程式为:Na2S+Cl2=2NaCl+S↓.
故答案为:A;有淡黄色沉淀生成;Na2S+Cl2=2NaCl+S↓;置换;
(4)从氯原子和硫原子的核外电子排布可知:Cl与S分别为第三周期元素的VIIA和VIA,原子半径:S>Cl,因为Cl的核电荷数大于S,Cl的原子核对最外层电子的吸引能力比S强,即Cl的电子能力比S强,非金属性Cl比S强.答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强.
故答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强;
(5)我们可从最高价氧化物对应水化物的酸性强弱、与氢气反应的难以程度、气态氢化物的稳定性等来判断元素非金属性的强弱,对Cl和S来说,可具体为:HCl的稳定性比H2S的稳定性强或者HClO4的酸性比H2SO4的酸性强.
故答案为:HCl的稳定性比H2S的稳定性强或者HClO4的酸性比H2SO4的酸性强.(其他合理答案均可);
(6)判断元素金属性强弱的依据有:最高价氧化物对应水化物的碱性强弱、单质与水或酸反应置换出氢气的剧烈程度、金属之间的置换反应等,而判断元素具有金属的依据与之不同,如(5)所述.因此,Cl元素的化合价既有升高又有降低,不能说明氯元素既具有金属性又具有非金属性.本题答案为:金属性强弱的判断以元素的单质与水(或酸)反应置换氢的难易程度,以及它的最高价氧化物的水化物的碱性强弱为依据.非金属性的强弱以它与氢气生成氢化物的稳定性或它的最高价氧化物的水化物的酸性强弱来判断.
故答案为:不能;金属性强弱的判断以元素的单质与水(或酸)反应置换氢的难易程度,以及它的最高价氧化物的水化物的碱性强弱为依据.非金属性的强弱以它与氢气生成氢化物的稳定性或它的最高价氧化物的水化物的酸性强弱来判断.(其他合理答案均可)
本题解析:
本题难度:一般
5、选择题 下列关于Cl2的描述中,正确的是
A.液氯可以密封保存在钢瓶中
B.红热的铜丝在Cl2中燃烧后生成蓝色的CuCl2
C.过量的铁在Cl2中燃烧生成氯化亚铁
D.Cl2以液态形式存在时可称作氯水或液氯
参考答案:A
本题解析:略
本题难度:一般