1、选择题 某元素原子L层电子数比K层的多5个,该元素的最高正化合价为
A.+5
B.+6
C.+7
D.无最高正化合价
参考答案:D
本题解析:略
本题难度:一般
2、填空题 (15分)以下是元素周期表的一部分,根据给定的元素回答下列问题
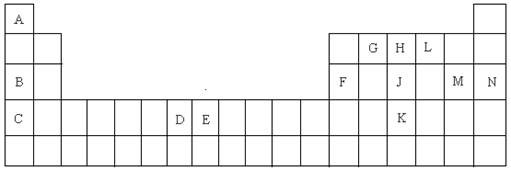
(1)K的元素符号是?;
(2)D元素的外围电子排布图是?,在其化合物中,最高正价是?;
(3)C元素的原子结构示意图是?;
(4)A与L、B与L都分别能形成原子个数比为1:1的化合物,A与L(1:1)的化合物是?分子(填极性或非极性),B与L(1:1)的化合物的电子式是?;
(5)G、H、L原子的第一电离能由高到低的顺序是?(填元素符号);
(6)J单质的一种白色同分异构体的空间构型是?;
(7)E元素在元素周期表中的位置是?,在其化合物中,常有+2、+3价的2种离子,+3的离子比较稳定,其原因是?;
(8)A与B的化合物的熔点比A与L的化合物的熔点高,其原因是?;
(9)A的单质与L的单质与B的最高价氧化物的水化物溶液能组成燃烧电池,写出该种电池的负极的电极反应式?;
(10)F元素的最高价氧化物与M元素的最高价氧化物的水化物反应的化学方程式是?
?。
参考答案:(1)? As ;(2)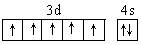 ,?+7?;(3)?
,?+7?;(3)? ?;
?;
(4)极性, ?;(5)? N O C?;(6)?正四面体;
?;(5)? N O C?;(6)?正四面体;
(7)?第四周期第Ⅷ族?,? Fe3+的3d轨道为半充满结构,更稳定?;
(8) NaH是离子化合物,H2O是共价化合物;(9)H2-2e-+2OH―=2H2O?;
(10) Al2O3+6HClO4=2Al(ClO4)3+3H2O (9、10每空2分,其余每空1分)
本题解析:略
本题难度:一般
3、选择题 下列说法错误的是?(?)
A.如果设“此”为电解质,“彼”为非电解质,不是所有的物质都是非此即彼的;
B.不是所有反应,都遵循由强(如强酸、强碱、强氧化剂或强还原剂等)制弱(如弱酸、弱碱、弱氧化剂 或弱还原剂等)的规律;
C.不是所有自发进行的反应都一定是焓减的过程;
D.在迄今发现的元素中,不一定所有非金属元素(稀有气体除外)都满足条件‘ 主族元素的族序数≥其周期序数’
参考答案:D
本题解析:只有化合物才可能是电解质或非电解质,A正确。例如H2S+CuSO4=CuS+H2SO4,B正确。根据△G=△H-T·△S可知,只要△G小于0,反应即自发进行,C正确所有非金属元素(稀有气体除外)都满足条件‘ 主族元素的族序数≥其周期序数’,D不正确。答案选D。
本题难度:简单
4、填空题 短周期元素X、Y、Z在周期表中的位置关系如右图所示,据此回答下列问题:
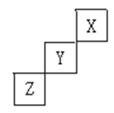
(1)X元素形成单质的分子式是_______?___;
(2)写出Y元素形成的单质跟水反应的化学方程式:_____?_______;
(3)写出单质Z与钠反应的化学方程式:______?___________。
参考答案:(1)He? (2)2F2+2H2O====4HF+O2?(3)2Na+S=Na2S
本题解析:(1)根据元素在周期表中的相对位置可知,X是He,Y是F,Z是S。所以X元素形成单质的分子式是He。
(2)F元素是最活泼的非金属,能和水反应生成HF和氧气,反应的方程式是2F2+2H2O=4HF+O2。
(3)钠和S反应生成硫化钠,反应的方程式是2Na+S=Na2S。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。旨在考查学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
5、选择题 H2O2的摩尔质量为(?)
A、18g? B 34g? C、 18g/mol? D 、34g/mol
参考答案:D
本题解析:如果质量用克为单位,摩尔质量在数值上等于该物质的相对分子质量或相对原子质量,实验室的相对分子质量是34,所以其摩尔质量是34g/mol,答案选D。
本题难度:简单