1、选择题 有X、Y、Z、M四种金属,已知:M投入水中可与水剧烈反应;用X和Z作电极,稀硫酸作电解质溶液构成原电池时,Z有气泡产生; Y和Z的离子共存于电解液中电解,阴极析出Y。则这四种金属的活动性由强到弱的顺序是
A.X > Z > Y > M
B.X > M > Z > Y
C.M > Y > Z > X
D.M > X > Z > Y
参考答案:D
本题解析:考查金属活动性的判定
M可与水剧烈反应,应是极活泼金属
用X和Z作电极构成原电池,Z有气泡产生说明Z为正极,活性较差, X > Z
Y和Z的离子共存于电解液中电解,阴极析出Y,说明Y的离子的氧化性较强,则其金属活泼性较差,即Z > Y
综合可知:M > X > Z > Y
本题难度:简单
2、填空题 (9分)下图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,上层溶液为盐溶液,呈中性,请根据图示回答下列问题:
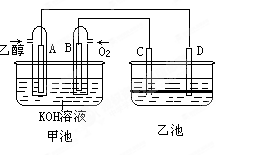
(1)通入乙醇(C2H5OH)的惰性电极的电极反应式为 。
若甲池可以充电,充电时A接电源的负极,此时B极发生的电极反应式为 。
(2)在乙池反应过程中,可以观察到 电极周围的溶液呈现棕褐色,反应完毕后,用玻璃棒搅拌溶液,则下层溶液呈现紫红色,上层接近无色,C极发生的电极反应 。
(3)若在常温常压下,1gC2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为 。
参考答案:(1)C2H5OH+16OH--12e-=2CO32-+11H2O (2分)
4OH--4e-=2H2O+O2↑ (2分)
(2)C (1分) 2I--2e?=I2 (2分)
(3)C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l);△H=-1366.7kJ/mol (2分)
本题解析:(1)通入乙醇的电极为原电池的负极,乙醇失去电子生成碳酸根离子,电极反应为:C2H5OH+16OH--12e-=2CO32-+11H2O。充电时,B极为电解池的阳极,是溶液中的氢氧根离子放电,电极反应为:4OH--4e-=2H2O+O2↑。(2)根据现象分析,乙池中产生了碘单质,所以碘单质是由碘离子是失去电子生成的,所以应该在电解池的阳极生成,则应和原电池的正极连接,所以为C极。电极反应为:2I--2e?=I2。(3)根据1克乙醇燃烧放出29.7kJ的热量,计算1摩尔乙醇燃烧放出的热量为29.7×46=1366.7kJ,所以热化学方程式为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l);△H=-1366.7kJ/mol。
考点:原电池的电极反应,电解原理的应用,热化学方程式的书写。
本题难度:困难
3、填空题 银器皿日久表面逐渐变黑色,这是由于生成了硫化银(Ag2S)。有人设计用原电池的原理进行“抛光”,其处理方法为:将一定浓度的食盐溶液放入一铝制容器中,再将变黑的银器浸入溶液中,放置一段时间后,黑色会褪去而银恢复光泽,且不会损失。试回答:
(1)食盐的作用是______________________。
(2)在此原电池反应中,负极发生的电极反应为_____________________________,正极发生的电极反应为____________________________。
(3)反应过程中产生臭鸡蛋气味的气体,溶液中发生的反应为2Al3++3S2-+6H2O==2Al(OH)3↓+3H2S↑,则原电池总反应方程式为____________________________。
参考答案:(1)食盐溶于水形成电解质溶液
(2)Al-3e-==Al3+;Ag2S+2e-==2Ag+S2-
(3)3Ag2S+2Al+6H2O==6Ag+2Al(OH)3↓+3H2S↑
本题解析:
本题难度:一般
4、填空题 (9分)砷(As)广泛分布与自然界,砷与氮同主族,比氮多两个电子层。
(1)砷位于元素周期表中_____周期________族,其气态氢化物的稳定性比NH3_______(填“强”或“弱”);
(2)砷的常见酸性氧化物有As2O3和As2O5,请根据图中信息写出As2O3分解为As2O5的热化学方程式:________________________;

(3)已知:将酸滴入砷酸盐与KI混合的溶液中发生反应:AsO43-+2I
参考答案:
本题解析:
本题难度:一般
5、填空题 现有A、B、C、D四种金属,若将A和B用导线相连,浸入稀硫酸中,A上有气泡产生;若将D放入B的硝酸盐溶液中,D表面有B析出;若在含有A和C两种离子的盐溶液中进行电解,阴极上有C析出。试判断,这四种金属还原性递减的顺序是?,若四种金属之一是铜,铜可能是?,不可能是?。
参考答案: ,A、C,? D、B
,A、C,? D、B
本题解析:略
本题难度:简单