1、填空题 (6分)(1)X、Y、Z三种金属,X、Y组成原电池,X是负极;把Y放在Z的硝酸盐溶液中,Y表面有Z析出。其活泼顺序是_________________;
(2)由氢气和氧气反应生成1mol水蒸气放热241.8 kJ,写出该反应的热化学方程式:___________________________?_______。
(3)下列各情况,在其中Fe片腐蚀由快到慢的顺序是?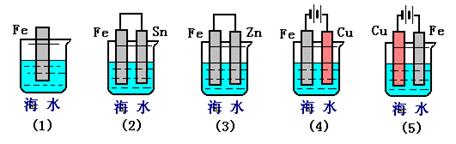
参考答案:(1)X>Y>Z
(2)2H2(g)+O2(g)=2H2O(g)?△H=-483.6 kJ·mol-1
(3)?⑸⑵⑴⑶⑷
本题解析:(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。X、Y组成原电池,X是负极,因此X的金属性强于Y;Y放在Z的硝酸盐溶液中,Y表面有Z析出,则Y的金属性强于Z,所以金属性强弱顺序是X>Y>Z。
(2)氢气和氧气反应生成1mol水蒸气放热241.8 kJ,所以该反应的热化学方程式是)2H2(g)+O2(g)=2H2O(g)?△H=-483.6 kJ·mol-1。
(3)根据装置图可知,(1)装置是铁的化学腐蚀,(2)、(3)是原电池,其中(2)中铁是负极加速腐蚀,(3)中铁是正极,被保护;(4)、(5)是电解池,其中(4)中铁是阴极,被保护,(5)中铁是阳极,失去电子,加快腐蚀,所以铁片腐蚀由快到慢的顺序是⑸⑵⑴⑶⑷。
本题难度:一般
2、填空题 银锌电池广泛用作各种电子仪器的电源,其电极分别是Ag2O和锌,电解液为KOH溶液。电池反应是:Ag2O+Zn+H2O="2Ag" +Zn(OH)2,根据上述判断:
(1)原电池的正极是__________,负极是__________。
(2)原电池电极反应式为:负极_______________,正极______________。
(3)工作时原电池负极附近溶液的pH__________ (填“增大”、“不变”、“减小”)。
参考答案:(5分)(1)Ag2O,? Zn。
(2)Zn+ 2OH--2e-=Zn(OH)2;Ag2O+H2O+2e-=2Ag+ 2OH-。?(3)减小
本题解析:(1)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据方程式可知,锌失去电子,作负极。氧化银得到电子,做正极。
(2)负极锌失去电子,电极反应式是Zn+ 2OH--2e-=Zn(OH)2。正极氧化银得到电子,电极反应式是Ag2O+H2O+2e-=2Ag+ 2OH-。
(3)根据负极电极反应式可知,工作时原电池负极消耗OH-,所以附近溶液的pH减小。
点评:该题是基础性试题的考查,侧重对学生基础知识的巩固,难度不大。该题的关键是明确原电池的工作原理,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般
3、填空题 如图所示,烧杯内盛有浓HNO3,在烧杯中放入用导线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余。试依次写出Fe电极上可能发生的电极反应式:____________、___________(可不填满,也可补充)
参考答案:4H++2NO3—+2e-=2NO2↑+2H2O、Fe-2e-=Fe2+
本题解析:由于浓硝酸能使铁方式钝化,所以开始阶段,铁电极是正极,铅是负极;随着反应的进行,硝酸的浓度逐渐降低,而稀硝酸能溶解铁,所以后阶段,铁又是负极,铅是正极。有关的方程式是4H++2NO3—+2e-=2NO2↑+2H2O、Fe-2e-=Fe2+。
本题难度:一般
4、填空题 我国首创的以铝、空气、海水为能源的新型海水标志灯已研制成功。这种灯以海水为电解质,靠空气中的氧气使铝不断氧化而产生电能,其正极电极反应式为: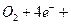
 ,负极电极反应式为:
,负极电极反应式为: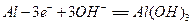 ,只要将灯放入海水中,数分钟后就会发出耀眼的光,其能量比电池高20~50倍。
,只要将灯放入海水中,数分钟后就会发出耀眼的光,其能量比电池高20~50倍。
(1)此种新型电池的负极材料是?
(2)电池总反应式为?
参考答案: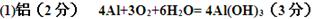
本题解析:略
本题难度:一般
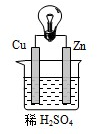
5、选择题 如图为铜锌原电池示意图,下列说法中正确的是( )
A.铜是电池的负极,锌是正极
B.电子由Cu片经导线流向Zn片
C.Cu极附近溶液因产生Cu2+而变蓝
D.电池总反应:Zn+2H+=Zn2++H2↑