1、选择题 某课外实验小组设计的下列实验合理的是( )

| 
| 
| 
|
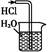
A.制备少量氨气
| B.吸收HCl
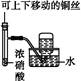
| C.配制一定浓
度硫酸溶液
| D.制备并收集
少量NO2气体
|
?
参考答案:A
本题解析:实验室利用NH4Cl与Ca(OH)2反应制备氨气,由于氨气的密度比空气小,且极易溶于水,应用向下排空气法收集,A项正确;HCl极易溶于水,直接用导管插入水中吸收,会产生倒吸现象,B项错误;浓硫酸溶于水产生大量热,因此配制一定浓度硫酸溶液时,浓硫酸应在烧杯中稀释,冷却至室温后再转移到容量瓶中,C项错误;NO2可与水反应,不能用排水法收集,D项错误。
本题难度:一般
2、实验题 FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
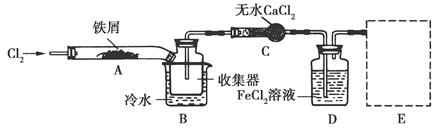
Ⅰ.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为______________。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是________。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号)________。
(4)装置B中冷水浴的作用为________;装置C的名称为________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:________。
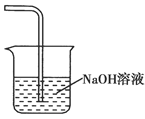
(5)在虚线框中画出尾气吸收装置E并注明试剂。
Ⅱ.该组同学用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫;过滤后,再以石墨为电极,在一定条件下电解滤液。
(6)FeCl3与H2S反应的离子方程式为________________。
(7)电解池中H+在阴极放电产生H2,阳极的电极反应式为____________________。
(8)综合分析实验Ⅱ的两个反应,可知该实验有两个显著优点:
①H2S的原子利用率为100%;②________________。
参考答案:(1)2Fe+3Cl2 2FeCl3
2FeCl3
(2)在沉积的FeCl3固体下方加热
(3)②⑤
(4)冷却,使FeCl3沉积,便于收集产品 干燥管
K3[Fe(CN)6]溶液
(5)
(6)2Fe3++H2S=2Fe2++S↓+2H+
(7)Fe2+-e-=Fe3+
(8)FeCl3得到循环利用
本题解析:根据FeCl3的性质及物质制备的相关知识解答。
(1)Cl2和Fe的反应为3Cl2+2Fe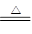 2FeCl3。(2)根据FeCl3加热易升华的性质,可以对反应管中沉积FeCl3的部位加热,使其升华。(3)为了防止FeCl3潮解,②赶尽装置中的空气,防止水蒸气存在;⑤冷却时要在Cl2中冷却,并用干燥的N2赶尽Cl2。(4)装置B中冷水浴的作用是将FeCl3蒸气冷却为FeCl3固体。装置C为干燥管。检验
2FeCl3。(2)根据FeCl3加热易升华的性质,可以对反应管中沉积FeCl3的部位加热,使其升华。(3)为了防止FeCl3潮解,②赶尽装置中的空气,防止水蒸气存在;⑤冷却时要在Cl2中冷却,并用干燥的N2赶尽Cl2。(4)装置B中冷水浴的作用是将FeCl3蒸气冷却为FeCl3固体。装置C为干燥管。检验
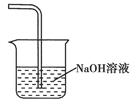
FeCl2是否失效就是检验D中是否存在Fe2+,可以用K3[Fe(CN)6]溶液检验,现象:若存在Fe2+,溶液中有蓝色沉淀生成。(5)Cl2是有毒气体,可以用碱液吸收,如右图所示。(6)H2S与FeCl3发生氧化还原反应:2Fe3++H2S=2Fe2++S↓+2H+。(7)因为阳极材料为石墨,故阳极是溶液中的Fe2+放电:Fe2+-e-=Fe3+。(8)实验Ⅱ的显著优点是①H2S的利用率高,②FeCl3可以循环利用。
点拨:知识:物质的制备、尾气的处理、离子的检验等化学实验知识,离子方程式和电极反应式的书写。能力:着重考查学生分析、解决问题的能力。试题难度:中等。
本题难度:一般
3、选择题 下列实验操作正确的是
[? ]
A.使用容量瓶配制溶液,移液时应洗涤烧杯和玻璃棒2~3次
B.用50mL量筒量取2.5mL稀盐酸
C.用托盘天平称量11.50g NaCl固体
D.用托盘天平称量NaOH固体时,不能直接放在盘上称,应放在纸上称
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列实验能达到目的的是
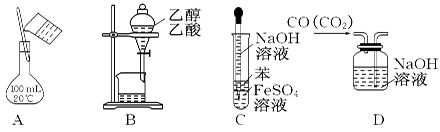
A.配制150 mL 0.10 mol/L盐酸
B.除去乙醇中的乙酸
C.制备Fe(OH)2
D.除去CO中的CO2
参考答案:C
本题解析:A不正确,容量瓶的规格不对;乙酸和乙醇互溶,不能分液分离,B不正确;D不正确,应该是长进短出;C中苯能隔离空气氧化氢氧化亚铁,所以正确的答案选C。
本题难度:一般
5、实验题 (12分)(1)指出在使用下列仪器(已经洗涤干净)或用品时的第一步操作:
①石蕊试纸(检验气体):___________________________________________。
②容量瓶:________________________________________________________。
③托盘天平________________________________________________________。
(2)①现有0.1mol/L的纯碱溶液,请用离子方程式表示纯碱溶液呈碱性的原因:___________________________________________________________________。
②为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案:___________________________________________________________________。
参考答案:(1)①把试纸用蒸馏水湿润?②检查容量瓶是否漏水
③调节天平零点
(2)①CO32-+H2O HCO3-+OH-? ②向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去,说明纯碱呈碱性是由CO32-引起的。(合理答案均可。但若是回答“测氯化钠溶液显中性”,并不能推知含相同钠离子的溶液不显碱性的原因,因为还要证明氯离子是否有影响)
HCO3-+OH-? ②向纯碱溶液中滴入酚酞溶液,溶液显红色;若再向该溶液中滴入过量氯化钙溶液,产生白色沉淀,且溶液的红色褪去,说明纯碱呈碱性是由CO32-引起的。(合理答案均可。但若是回答“测氯化钠溶液显中性”,并不能推知含相同钠离子的溶液不显碱性的原因,因为还要证明氯离子是否有影响)
本题解析:(1)中是考查一些基本实验操作的步骤,特别是实验成功与否的关键一步。需要同学们注意理解记忆,并能够用规范化的学科语言进行回答。但一些同学记忆时只是记个大概,当回答时就会出现语言罗里罗嗦,导致答不到要点而失分。
(2)中注意审题,一是用离子方程式表示纯碱溶液呈碱性的原因,二是设计实验方案。而一个完整的实验方案一般包括:实验原理、试剂及用品、实验步骤(操作)、现象和结论。同学们回答时容易遗漏而失分。
本题难度:一般