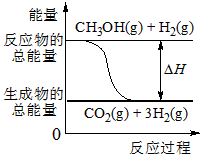
1、填空题 选做(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。根据下图回答下列问题:
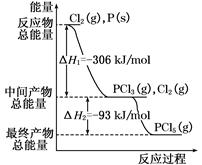
(a)P和Cl2反应生成PCl3的热化学方程式是______________________________ ;
(b)P和Cl2分两步反应生成1 mol PCl5的ΔH3=____________________,P和Cl2一步反应生成1 mol PCl5的ΔH4____________ΔH3(填“大于”.“小于”.或“等于”)。
(2)在微生物作用的条件下,NH经过两步反应被氧化成NO。这两步的能量变化示意图如下:

(a)第二步反应是________反应(选填“放热”或“吸热”),判断依据是__________ 。
(b)1molNH4+(aq)全部氧化成NO2-(aq)的热化学方程式是_____________________________________。
2、选择题 运用盖斯定律可方便地计算出难以通过实验直接测定的反应热。已知:
①P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1
②P(红磷,s)+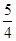 O2(g)=
O2(g)=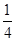 P4O10(s) ΔH=-738.5kJ·mol-1
P4O10(s) ΔH=-738.5kJ·mol-1
则白磷转化为红磷的热化学方程式为
A.P4(白磷,s)=4P(红磷,s) △H=-29.2kJ·mol-1
B.P4(白磷,s)=4P(红磷,s) △H=+29.2kJ·mol-1
C.P4(白磷,s)=4P(红磷,s) △H=-2244.7kJ·mol-1
D.P4(白磷,s)=4P(红磷,s) △H=+2244.7kJ·mol-1