1、填空题 X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
元素
| 相关信息
|
X
| X的基态原子核外3个能级上有电子,且每个能级上的电子数相等
|
Y
| 双原子分子单质在标准状况下密度为1.429g/L
|
Z
| 单质及其化合物的焰色反应为黄色
|
W
| W元素基态原子的M层全充满,N层只有一个电子
|
(1)X位于元素周期表位置为第第__________周期第_________族。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于 晶体。
(2)X与Y中电负性较强的是(填元素符号) ;XY2的电子式是 ,分子中存在 的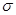 键和
键和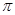 键的个数比是 。
键的个数比是 。
(3)Z2Y2中含有的化学键类型有 ;W的基态原子核外电子排布式是 。
(4)废旧印刷电路板上有W的单质A。用H2O2和H2SO4的混合溶液可溶出印刷电路板上的A。已知:
①A(s)+H2SO4(aq) ="=" ASO4 (aq) + H2(g) ΔH=+64.4kJ·mol-1
②2H2O2(l) ="=" 2H2O(l) + O2(g) ΔH= -196.4kJ·mol-1
③H2(g)+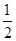 O2(g) ="=" H2O(l) ΔH= -285.8kJ·mol-1
O2(g) ="=" H2O(l) ΔH= -285.8kJ·mol-1
请写出A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式(A用化学式表示): 。
参考答案:(14分)
(1)二 IV A (分) 原子(每空1分)
(2)O (1分) 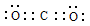 (2分) 1:1(1分)
(2分) 1:1(1分)
(3)离子键、非极性键(或共价键) (2分) [Ar]3d104s1 (2分)
(4)Cu (s) + H2O2(l) + H2SO4(aq) = CuSO4(aq) + 2H2O (l) ?H =" -" 319.6 kJ / mol (3分)
本题解析:X的基态原子核外3个能级上有电子,且每个能级上的电子数相等,则X的核外电子排布是1s22s22p2,所以X是C元素;Y的双原子分子单质在标准状况下密度为1.429g/L,则相对分子质量是1.429×22.4=32,所以Y的相对原子质量是16,则Y是O元素;焰色反应为黄色的元素为Na,则Z是Na元素;W元素基态原子的M层全充满,N层只有一个电子,则W的电子层排布是2、8、18、1,所以W为Cu元素。
(1)C元素位于元素周期表的第二周期IVA族;C元素组成的单质中,金刚石熔点很高,硬度很大,属于原子晶体;
(2)C与O元素中电负性较强的是O;二氧化碳是共价化合物,C与O原子之间形成2对共用电子对,所以电子式是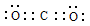 ;C=O中有1个
;C=O中有1个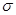 键和1个
键和1个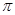 键,所以
键,所以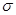 键和
键和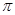 键的个数比是1:1;
键的个数比是1:1;
(3)过氧化钠属于离子化合物,含有离子键,且O与O原子之间是共价键,所以过氧化钠中既含离子键又含共价键;Cu的基态原子的核外电子排布式是[Ar]3d104s1;
(4)A是Cu单质,根据盖斯定律,将氧气与氢气消去,①+③+②/2,可得所求热化学方程式,所以A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式为Cu (s) + H2O2(l) + H2SO4(aq) = CuSO4(aq) + 2H2O (l)?H =(64.4-285.8)kJ/mol-196.4/2kJ/mol="-" 319.6 kJ / mol。
考点:考查元素的推断,盖斯定律的应用,化学用语的书写
本题难度:困难
2、选择题 下列说法正确的是( )
A.热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量
B.热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据
C.书写热化学方程式时,不仅要写明反应热的符号和数值,还要注明各物质的聚集状态
D.凡是化合反应都是放热反应,分解反应都是吸热反应
参考答案:C
本题解析:
本题难度:简单
3、简答题 乙醇是重要的化工原料和液体燃料,可以利用下列反应制取乙醇:
2CO2(g)+6H2(g)?
?CH3CH2OH(g)+3H2O(g)
(1)写出该反应的平衡常数表达式:K=______.
(2)在一定压强和温度下,在反应物总物质的量相同的情况下,测得该反应的实验数据如下表:
温度/℃CO2转化率/%
n(H2)/n(CO2) | 500 | 600 | 700 | 800
1.5
45
33
20
12
2.0
60
43
28
15
3.0
83
62
37
22
|
①该反应是______反应(填“吸热”或“放热”).
②提高氢碳比[n(H2)/n(CO2)],则CO2的转化率______;化学平衡______移动,平衡常数K______(填“增大”、“减小”、或“不变”).
(3)一种乙醇燃料电池中发生的化学反应为:在酸性溶液中乙醇与氧气作用生成水和二氧化碳.该电池的负极反应式为:______.
若以上述燃料电池为电源来电解饱和食盐水,当消耗46g乙醇时,电解产生的H2体积(标况)为______L.
(4)25℃、101kP a下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ?mol-1、1411.0kJ?mol-1和1366.8kJ?mol-1,请写出由C2H4(g)和H2O(l)反应生成C2H5OH(l)的热化学方程式______.
参考答案:(1)反应为2CO2(g)+6H2(g)?催化剂.△?CH3CH2OH(g)+3H2O(g),则K=c3(H2O)×c(CH3CH2OH)c2(CO2)×c6(H2),
故答案为:c3(H2O)×c(CH3CH2OH)c2(CO2)×c6(H2);
(2)①由表中数据可知,温度越高,二氧化碳的转化率越低,则升高温度,化学平衡逆向移动,则正反应为放热反应,故答案为:放热;
②由表中的数据可知,相同温度时,提高氢碳比[n(H2)/n(CO2)],则CO2的转化率增大,化即学平衡正向移动,但温度不变,则K不变,
故答案为:增大;正向;不变;
(3)酸性条件下,乙醇在负极发生氧化反应,则负极反应为C2H5OH-12e-+3H2O=2CO2+12H+,
由电子守恒可知C2H5OH~12e-~6H2↑,n(C2H5OH)=46g46g/mol=1mol,
则n(H2)=6mol,其标况下的体积为6mol×22.4L/mol=134.4L,
故答案为:C2H5OH-12e-+3H2O=2CO2+12H+;134.4;
(4)25℃、101kPa下,H2(g)、C2H4(g)和C2H5OH(l)的燃烧热分别是285.8kJ?mol-1、1411.0kJ?mol-1和
1366.8kJ?mol-1,
则H2(g)+12O2(g)=H2O(l)△H=-285.8kJ?mol-1①,
C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1411.0kJ?mol-1②,
C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.8kJ?mol-1③,
由盖斯定律可知,②-③可得反应C2H4(g)+H2O(l)=C2H5OH(l),
其反应热为-1411.0kJ?mol-1-(-1366.8kJ?mol-1)=-44.2?kJ?mol-1,
热化学方程式为C2H4(g)+H2O(l)=C2H5OH(l)△H=-44.2?kJ?mol-1,
故答案为:C2H4(g)+H2O(l)=C2H5OH(l)△H=-44.2?kJ?mol-1.
本题解析:
本题难度:一般
4、选择题 下列化学用语使用正确的是
[?]
A.Na2O2的电子式: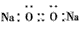
B.表示中和热的热化学方程式:NaOH+HCl==NaCl+H2O △H= - 57.3 kJ/mol
C.苯酚钠溶液中通入CO2的离子方程式:C6H5O-+ CO2+ H2O → C6H5OH+ HCO3-
D.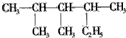 的名称:2,3-二甲基-4-乙基戊烷
的名称:2,3-二甲基-4-乙基戊烷
参考答案:C
本题解析:
本题难度:一般
5、填空题 (1)图1是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:______.

(2)观察图2a和b,根据盖斯定律,写出△H1、△H2、△H3、△H4、△H5和△H6的关系.
图a:______;
图b:______.
参考答案:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1,
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1;
(2)图a:以A为起点,最终又回到A,整个过程没有能量变化,所以△H1+△H2+△H3+△H4+△H5+△H6=0;
图b:变化有两个途径A→F,A→B→C→D→E→F,两个途径的热效应相同,所以△H1+△H2+△H3+△H4+△H5=△H6,
故答案为:△H1+△H2+△H3+△H4+△H5+△H6=0;△H1+△H2+△H3+△H4+△H5=△H6.
本题解析:
本题难度:一般