1、实验题 (18分)Na2S2O3是重要的化工原料,易溶于水。在中性或碱性环境中稳定。
I.制备Na2S2O3?5H2O
反应原理:Na2SO3(aq)+S(s) Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15g Na2SO3加入圆底烧瓶中,再加入80ml蒸馏水。另取5g研细的硫粉,用3ml?乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分加持装置略去),水浴加热,微沸60分钟。
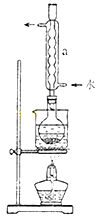
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3?5H2O,经过滤,洗涤,干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是?。
(2)仪器a的名称是?,其作用是?。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是?,检验是否存在该杂质的方法是?。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因:?
?。
II.测定产品纯度
准确称取Wg产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000 mol?L?1碘的标准溶液滴定。
反应原理为:2S2O32?+I2=S4O62-+2I?
(5)滴定至终点时,溶液颜色的变化:?。
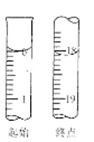
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为?mL。产品的纯度为(设Na2S2O3?5H2O相对分子质量为M)?。
III.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42?,常用作脱氧剂,该反应的离子方程式为?。
2、选择题 实验是化学研究的基础,下列关于各实验装置的叙述正确的是
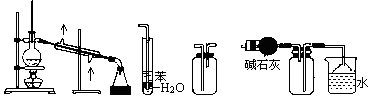
①?②?③?④
A.装置①常用于分离互相溶解且沸点相差10℃以上的液态混合物
B.装置②可用于吸收NH3或HCl气体,并防止到吸
C.装置③可用于收集H2、CO2、Cl2、NH3等气体
D.装置④可用于干燥、收集氨气,若将碱石灰改成五氧化二磷,可用于干燥、收集氯化氢
3、选择题 下列对实验现象的解释与结论正确的是
编号
| 实验操作
| 实验现象
| 解释与结论
|
A
| 向某溶液中加入BaCl2溶液
| 有白色沉淀产生
| 生成了难溶于水的BaSO4,
该溶液中一定含有SO42-
|
B
| 向鸡蛋清溶液中,
加入饱和(NH4)2SO4溶液
| 有白色沉淀产生
| 蛋白质发生了盐析
|
C
| 向甲苯中滴入少量浓溴水,
振荡,静置
| 溶液分层,上层呈橙红色,下层几乎无色
| 甲苯和溴水发生取代反应,
使溴水褪色
|
D
| 向蔗糖中加入浓硫酸
| 变黑,放热,体积膨胀,放出刺激性气体
| 浓硫酸具有吸水性和强氧化性,
反应中生成C、SO2和CO2等
4、选择题 有 Al2(SO4)3 ,FeSO4,CuCl2, NaOH四种溶液,将其两两反应,若有一种溶液滴入另两种溶液中均产生了白色沉淀,继续滴加该溶液,原白色沉淀或消失或发生颜色变化,则可推断这一种溶液是?(?)
A.Al2(SO4)3
B.FeSO4
C.BaCl2
D.NaOH
5、填空题 溴化钙(CaBr2·2H2O)是一种白色晶体,易溶于水,有很强的吸湿性,是光敏纸矿泉水和灭火剂的重要成分,在医药上用作治疗神经衰弱等的药物,也用作化学分析。用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下

回答下列问题
(1)溶解时发生的主要反应的离子方程式为?
(2)除杂步骤控制溶液的pH约为8.0的目的是?,?
(3)滤液用氢溴酸酸化的目的是?,操作a主要包括?,?和过滤
(4)制得的溴化钙晶体可以通过如下步骤测定其纯度:
①称取5.00g溴化钙晶体样品,②溶解;③滴入足量Naa2CO3溶液,充分反应后过滤,④烘干、冷却;⑤称量。若得到2. 00 g碳酸钙,则样品的纯度为?
(5)溴化钙晶体中溴离子和钙离子的检验
①将少量溴化钙晶体溶于水,加入硝酸酸化的AgNO3溶液,实验现象为?,发生反应的离子方程式为?
②将少量溴化钙晶体溶于水,滴加草酸钠溶液,实验现象为?,发生反应的离子方程式为?
|