1、选择题 在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol·L-1,c(B)="0.200" mol·L-1,c(C)="0" mol·L-1。反应物A的浓度随时间的变化如右图所示。下列说法正确的是?(?)
C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)="0.100" mol·L-1,c(B)="0.200" mol·L-1,c(C)="0" mol·L-1。反应物A的浓度随时间的变化如右图所示。下列说法正确的是?(?)

A.反应A+2B C的△H>0
C的△H>0
B.若反应①、②的平衡常数分别为K1、K2,则K1< K2?
C.实验②平衡时B的转化率为60%
D.减小反应③的压强,可以使平衡时c(A)="0.060" mol·L-1
参考答案:A
本题解析:与①比较,②到达平衡的时间缩短,但A的浓度没变,平衡没动,所以②为使用催化剂的情况。温度没有改变,所以②与①的平衡常数相同,B错。平衡时A的浓度为0.060 mol·L-1,所以A转化了0.040 mol·L-1,则B转化0.080 mol·L-1,转化率为0.080/0.200*100%=40%,C错。③与①比较,到达平衡的时间缩短,A的浓度减小,说明反应速率加快,平衡正向移动了,因为是在溶液中进行的反应,各物质的起始浓度又相同,所以该情况是由升高温度导致的。则推出正反应吸热,△H>0,A对。减小反应③的压强,A的浓度会瞬间减小,平衡逆向移动,但根据勒夏特列原理,A的浓度减小就是减小了,平衡移动只是减弱了“A的浓度减小”的程度, D错。故选A
本题难度:一般
2、选择题 T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)?ΔH <0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法正确的是
CH3OH(g)+H2O(g)?ΔH <0,容器中CH3OH的物质的量随时间变化如曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线II所示。下列说法正确的是

A.曲线II对应的条件改变是减小压强
B.若T2°C时上述反应的平衡常数为0.42,则T2< T1
C.在T10C,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则达平衡前v(正)>v(逆)
D.在T10C,若起始时向容器中通入4 .5 molCO2、6mol H2 ,平衡时容器内的压强P1=P/2
参考答案:C
本题解析:A.该反应是一个反应前后气体体积减小的放热反应,曲线II到达平衡所需时间较短,说明改变条件时反应速率加快,平衡时甲醇的物质的量增大,说明平衡向正反应方向移动,则改变的条件只能是增大压强,故A错误;B.T1℃时,各物质的平衡浓度分别为:c(CH3OH)=c(H2O)="3mol" 3L =1mol/L,c(CO2)=(9?3)mol 3L =2mol/L,c(H2)=(12?3×3)mol 3L =1mol/L,则平衡常数K="1×1/" 2×1×1 =0.5>0.42,平衡向逆反应方向移动平衡常数减小,所以T2>T1,故B错误;C.T1℃时,若起始时向容器中充入 5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则各物质的浓度分别为:c(CH3OH)=c(H2O)=c(CO2)=c(H2)="5" /3 mol/L,则浓度商="(5" /3 )2 /(5/ 3 )4 =0.36<0.5,则平衡向正反应方向移动,则达平衡前v(正)>v(逆),故C正确;D.T1℃时,若起始时向容器由充入4.5molCO2、6mol H2,如果转化率相同,则压强是I的一半,实际上,相对于I来说,相当于减小压强,平衡向逆反应方向移动,则压强大于原来的一半,故D错误;
本题难度:一般
3、填空题 在一个6L的密闭容器中,放入3L X(g)和2L Y(g),在一定条件下发生下列反应:4X(g)+ 3Y(g) 2Q(g)+nRcg),达到平衡后,容器内的温度不变,混合气体的压强比原来增加5%, X的浓度减小1/3,则该反应方程式中的n的值为 ____________
2Q(g)+nRcg),达到平衡后,容器内的温度不变,混合气体的压强比原来增加5%, X的浓度减小1/3,则该反应方程式中的n的值为 ____________
A.3
B.4
C.5
D.6
参考答案:D
本题解析:
本题难度:一般
4、填空题 (1)二氧化硫的催化氧化的过程如图所示,其中a、c二步的化学方程式可表示为:

SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3。
2V2O5+4SO3。
该反应的催化剂是?(写化学式)
(2) 550 ℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图所示。将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,体系总压强为0.10 M Pa。试计算反应2SO3 2SO2+O2在550 ℃时的平衡常数K=?。
2SO2+O2在550 ℃时的平衡常数K=?。
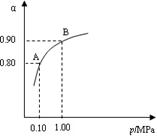
(3)550 ℃时,将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应 达平衡后,下列措施中能使n(SO3)/n(SO2)增大的是?
A.升高温度?
B.充入He(g),使体系总压强增大
C.再充入2 mol SO2和1 mol O2?
D.再充入1 mol SO2和1 mol O2
(4)维持温度不变条件下使之发生如下反应:2SO2+O2 2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。
2SO3,有两只密闭容器A和B。A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容。起始时向这两个容器中分别充入等物质的量的体积比为2∶1的SO2和O2的混合气体,并使A和B容积相等(如下图所示)。

试填写下列空格:
A容器达到平衡时所需的时间比B容器__________(填:“短或长”);平衡时A容器中SO2的转化率比B容器_______(填:“大或小”);达到所述平衡后,若向两容器中通入等物质的量的原反应气体,达到平衡时,A容器的混合气体中SO3的体积分数_________(填“增大”、“减小”或“不变”,下同);B容器的混合气体中SO3的体积分数_________。
参考答案:(1)V2O5;(2)400 L?mol-1;(3)CD;(4)短;大;不变;增大。
本题解析:(1)根据题给信息结合催化剂参与化学反应的机理分析,催化剂为V2O5;(2)根据化学平衡计算的三段式进行计算,由题给图像知,体系总压强为0.10M Pa,此时二氧化硫的转化率为80%,?2SO2+O2 2SO3
2SO3
起始量(mol)? 2?1?0
变化量 (mol)2×0.8? 0.8? 2×0.8
平衡量 (mol) 0.4? 0.2? 1.6
平衡时各物质的浓度为:[SO2]=0.08mol/L,[O2]=0.04mol/L,[SO3]="0.32mol/L" 代入平衡常数的表达式计算得到平衡常数K="400" L?mol-1;(3)550 ℃时,将2.0 mol SO2和1.0 mol O2置于5 L密闭容器中,反应达平衡后,要使n(SO3)/n(SO2)增大,平衡需向正向移动,A、该反应正向为放热反应,升高温度,平衡逆向移动,错误;B、充入He(g),使体系总压强增大,与反应相关的物质浓度不变,平衡不移动,错误;C、再充入2 mol SO2和1 mol O2,相当于加压,平衡正向移动,正确;D、再充入1 mol SO2和1 mol O2,平衡正向移动,正确;选CD;(4)因A容器保持恒压,反应过程中体积变小,浓度增大,根据浓度越大,化学反应速率越快,到达平衡的时间越短,所以达到平衡所需时间A比B短,A容器体积减少,压强增大,平衡向正反应方向移动,所以A中SO2的转化率比B大;向两容器中通入等量的原反应气体,达到平衡后,A中建立的平衡与原平衡等效,所以SO3的体积分数不变,B容器中建立的平衡相当于在原平衡的基础上增大压强,平衡正向移动,B容器中SO3的体积分数增大。
本题难度:困难
5、选择题 对于可逆反应 达到平衡时,下列说法中正确的是(?)
达到平衡时,下列说法中正确的是(?)
A.M、N、Q三种物质的浓度一定相等
B.M、N全部变成了Q
C.反应混合物各组分的浓度不再变化
D.压强不再变化
参考答案:C
本题解析:略
本题难度:简单