1、简答题 尿素[CO(NH2)2]是首个由无机物人工合成的有机物.
(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为______.
(2)当氨碳比
=4时,CO2的转化率随时间的变化关系如图1所示.
①A点的逆反应速率v逆(CO2)______B点的正反应速率v正(CO2)(填“大于”“小于”或“等于”).
②NH3的平衡转化率为______.
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图2所示.

①电源的负极为______(填“A”或“B”).
②阳极室中发生的反应依次为______、______.
③电解结束后,阴极室溶液的pH与电解前相比将______;若两极共收集到气体13.44L(标准状况),则除去的尿素为______g(忽略气体的溶解).
参考答案:(1)CO2和NH3合成CO(NH2)2,根据元素守恒可知,同时还有H2O生成,化学方程式为:
2NH3+CO2一定条件.CO(NH2)2+H2O,故答案为:2NH3+CO2一定条件.CO(NH2)2+H2O;
(2)①由CO2的转化率随时间变化图可知在A点时反应还未达到平衡状态,反应仍将继续正向进行,故v逆(CO2)小于B点平衡时的化学反应速率,故答案为:小于;
②设CO2的初始物质的量为a,则NH3的初始物质的量为4a,由图可知,CO2的转化率为60%,故转化的二氧化碳为a×60%=0.6a,根据方程式可知,转化的NH3的物质的量为0.6a×2=1.2a,故平衡时氨气的转化率定为1.2a4a×100%=30%,
故答案为:30%;
(3)①由图可知,左室电极产物为Cl2,发生氧化反应,故A为电源的正极,右室电解产物H2,发生还原反应,故B为电源
的负极,故答案为:B;
②由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl,阳极室中发生的反应依次为:6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,
故答案为:6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl;
③阴极反应为6H2O+6e-═6OH-+3H2↑(或6H++6e-═3H2↑)
阳极反应为6Cl--6e-═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
根据上述反应式可以看出在阴、阳极上产生的OH-、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH-恰好反应生成水,所以阴极室中电解前后溶液的pH不变;
由上述反应式可以看出,转移6mole-时,阴极产生3molH2,阳极产生1molN2和1molCO2,故电解收集到的13.44L气体,物质的量为13.44L22.4/mol=0.6mol,即n(N2)=n(CO2)=0.6mol×15=0.12mol,
根据方程式CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl可知生成0.12molN2所消耗的CO(NH2)2的物质的量也为0.12mol,其质量为:m[CO(NH2)2]=0.12mol×60g?mol-1=7.2g,
故答案为:不变,7.2;
本题解析:
本题难度:一般
2、选择题 对于N2(g)+3H2(g)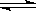 2NH3(g),不能作为反应达到平衡状态的判断依据是(?)
2NH3(g),不能作为反应达到平衡状态的判断依据是(?)
A.单位时间内生成1molN2,同时消耗3molH2
B.恒容密闭容器中总压强不变
C.生成氨气的速率与氨气分解的速率相等
D.N2、H2、NH3的浓度不再发生变化
参考答案:B
本题解析:可逆反应达到化学平衡状态的标志是正、逆反应速率相等、各组分浓度保持不变。单位时间内生成1molN2,为逆反应,同时消耗3molH2,为正反应,且v(正)=v(逆),A是平衡状态;反应正向进行时气体物质的量减小,定温、恒容密闭容器中气体的压强减小,所以压强不变不能说明反应达到平衡状态,需加定温条件,B错误;生成氨气的速率与氨气分解的速率相等即v(正)=v(逆),C是平衡状态;各组分浓度保持不变,说明反应达到平衡状态,D正确。
点评:理解化学平衡状态的直接标志(正、逆反应速率相等、各组分浓度保持不变)和间接标志(体系的压强、温度、颜色、平均摩尔质量等),但一定要分析清楚。
本题难度:一般
3、选择题 反应3A(g)+B(g)═2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为:①vA═1mol/L?min?②vC═0.5mol/L?min?③vB═0.5mol/L?min,三种情况下该反应速率大小的关系正确的是( )
A.③>①>②
B.③>②>①
C.①>②>③
D.②>①>③
参考答案:A
本题解析:
本题难度:简单
4、选择题 反应mA(s)+nB(g) pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) ΔH<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是

①m+n>p ? ②x点表示的正反应速率大于逆反应速率 ?③n>p ④x点比y点时的反应速率慢 ⑤若升高温度,该反应的平衡常数增大
A.①②⑤
B.只有②④
C.只有①③
D.①③⑤
参考答案:B
本题解析:反应mA(s)+nB(g) pC(g) ΔH<0,在一定温度下,从平衡时B的体积分数(B%)与压强变化的关系可以看到:随着压强的增大,B的体积分数在增大,则n<p,该反应是放热反应,所以升高温度,平衡向逆向移动,所以平衡常数会减小。X点时B的浓度大于平衡时的浓度,说明反应正在向正向移动,所以正反应的速率大于逆反应的速率。X点的压强小于y点的压强,所以x点的反应速率速率小于y点速率。故选B。
pC(g) ΔH<0,在一定温度下,从平衡时B的体积分数(B%)与压强变化的关系可以看到:随着压强的增大,B的体积分数在增大,则n<p,该反应是放热反应,所以升高温度,平衡向逆向移动,所以平衡常数会减小。X点时B的浓度大于平衡时的浓度,说明反应正在向正向移动,所以正反应的速率大于逆反应的速率。X点的压强小于y点的压强,所以x点的反应速率速率小于y点速率。故选B。
点评:.对于化学平衡的有关图象问题,可按以下的方法进行分析:
(1)认清坐标系,搞清纵、横坐标所代表的意义,并与勒夏特列原理挂钩。
(2)紧扣可逆反应的特征,看清正反应方向是吸热还是放热、体积增大还是减小、不变、有无固体、纯液体物质参加或生成等。
(3)看清速率的变化及变化量的大小,在条件与变化之间搭桥。
(4)看清起点、拐点、终点,看清曲线的变化趋势。
(5)先拐先平,数值大。例如,在转化率一时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。
(6)定一议二。当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系
本题难度:一般
5、填空题 8分)一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:2NO2(红棕色) N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为:?
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: ?mol·L-1·s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 ? (填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向??移动
(填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色 ? ?
(填“变深”、“变浅”或“不变”)
参考答案:(1)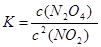 (2分)(2)0.1(2分)(3)t3?(1分)
(2分)(2)0.1(2分)(3)t3?(1分)
(4)>?(1分)(5)正反应应方向(1分)(6)变深?(1分)
本题解析:(1)平衡常数是指在一定条件下的可逆反应中,当反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该反应的平衡常数表达式为 。
。
(2)从t1至t2时N2O4的物质的量增加了4mol-3mol=1mol,所以反应速率是1mol÷1L÷10s=0.1mol/(L·s)。
(3)根据图像可知,t3时刻物质的物质的量不再发生变化,所以此时反应达到平衡状态。
(4)t1时NO2的物质的量逐渐减小,说明反应是向正反应方向进行的,即正反应速率大于逆反应速率。
(5)反应前后是体积减小的,所以缩小容积,压强增大,平衡向正反应方向移动,
(6)正反应是放热反应,所以升高温度,平衡向逆反应方向移动,NO2的浓度增大,颜色变深。
本题难度:一般