1、选择题 在一定温度下,饱和氯水中存在平衡:Cl2+H2O H++Cl-+HClO。下列说法中正确的是( )
H++Cl-+HClO。下列说法中正确的是( )
A.光照一段时间后,c(HClO)减小
B.加入碳酸钙粉末后,溶液的pH增大,可以提高HClO浓度
C.加入少量水,由水电离的c(H+)减小
D.加入少量NaOH固体,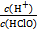 增大
增大
2、选择题 在一真空密闭容器中,充入10 mol N2和30 mol H2,发生N2+3H2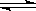 2NH3反应,在一定温度下达到平衡时,H2的转化率为25%。若在同一容器中在相同温度下充入NH3,欲达到平衡时各成分的百分含量与上述平衡相同,则起始时充入NH3的物质的量和达到平衡时NH3的转化率
2NH3反应,在一定温度下达到平衡时,H2的转化率为25%。若在同一容器中在相同温度下充入NH3,欲达到平衡时各成分的百分含量与上述平衡相同,则起始时充入NH3的物质的量和达到平衡时NH3的转化率
A.15 mol、25%
B.20 mol、50%
C.20 mol、75%
D.40 mol、80%
3、计算题 丙酮(CH3COCH3)和碘在酸性溶液中发生下列反应:CH3COCH3+I2→CH3COCH2I+H++I-。 25℃时,该反应的速率由下列经验式决定:v=2.73×10-5c(CH3COCH3)·c(H+)mol/(L·s),25 ℃时,如果c(I2)、c(CH3COCH3)、c(H+)的起始浓度依次是0.01 mol/L、0.1 mol/L、0.01 mol/L。求:
(1)反应开始时的速率;
(2)当溶液中的I2消耗一半时,反应速率比开始时慢还是快?
4、简答题 (14分)I.已知:C(s)+H2O(g) CO(g)+H2(g)?ΔH
CO(g)+H2(g)?ΔH
一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h
| 0
| 1
| 2
| 4
| 8
| 16
| 20
| 25
| 30
|
总压强p/100 kPa
| 4.56
| 5.14
| 5.87
| 6.30
| 7.24
| 8.16
| 8.18
| 8.20
| 8.20
|
回答下列问题:
(1)下列哪些选项可以说明该可逆反应已达平衡状态?。
A.混合气体的密度不再发生改变? B.消耗1 mol H2O(g)的同时生成1 mol H2
C.ΔH不变? D.v正(CO) = v逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总=____ mol;由表中数据计算反应达平衡时,反应物H2O(g)的转化率α =_____(精确到小数点后第二位)。
Ⅱ.硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:xSO2 (g)+2xCO(g)=2xCO2 (g)+Sx (s)? ΔH=ax kJ/mol?①
2xCOS(g)+xSO2 (g)=2xCO2 (g)+3Sx (s)? ΔH=bx kJ/mol。?②
则反应COS(g)生成CO(g)、Sx (s)的热化学方程式是?。
(2)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。试分析:
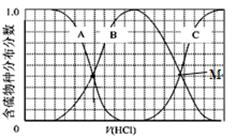
①B曲线代表?分数变化(用微粒符号表示);滴加过程中,溶液中一定成立:
c(Na+)=?。
②M点,溶液中主要涉及的离子方程式?。
5、选择题 下列说法错误的是( )
A.任何化学反应都有一定的限度,只是不同反应的限度不同罢了
B.化学反应的限度可以通过改变条件而改变,如浓度、温度和压强
C.可逆反应既可以向正反应方向进行,同时又可向逆反应方向进行的反应
D.当一个可逆反应进行到正向反应速率与逆向反应速率相等时,反应就停止了