1、填空题 常温下KMnO4氧化浓HCl的反应方程式如下:2KMnO4 +16HCl(浓)=2KCl+2MnCl 2+5Cl 2↑+8H2O
(1)用“双线桥法”标明反应中电子转移的方向和数目。
(2)又已知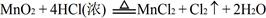 ,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是:??。
,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是:??。
(3)若有63.2g高锰酸钾参加反应,则被氧化的HCl的物质的量为?mol,产生的Cl2在标准状况下的体积为?L。
参考答案:(1)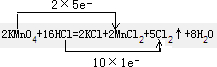 (2)KMnO4? MnO2? Cl2?(3)2? 22.4
(2)KMnO4? MnO2? Cl2?(3)2? 22.4
本题解析:(1)双线桥法标出反应中电子得失数目为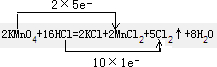 ;
;
(2)2KMnO4 +16HCl(浓)="2KCl" +2MnCl 2+5Cl 2↑?+8H2O此反应制取Cl2不需要条件,而在反应 中要加热,且MnO2是氧化剂, Cl2是氧化产物。所以有氧化性KMnO4 >MnO2 >Cl2
中要加热,且MnO2是氧化剂, Cl2是氧化产物。所以有氧化性KMnO4 >MnO2 >Cl2
(3)高锰酸钾的量、氯气的量以及消耗的盐酸之间的关系为:2KMnO4~5Cl2~16HCl,被氧化的盐酸和参加反应的盐酸的量之比为:10 :16 =5 :8 ,63.2g (即0.4mol)KMnO4完全反应时,产生的Cl2为1.0mol,在标准状况下的体积为1.0mol×22.4L/mol=22.4L,消耗的HCl为3.2mol,被氧化的HCl为2.0mol.
本题难度:一般
2、选择题 下列反应中必须加入氧化剂才能实现的是(?)
A.Cl2→Cl-
B.Zn→ Zn2+
C.H2→H2O
D.CuO→CuCl2
参考答案:BC
本题解析:氧化剂在化学反应中化合价降低,发生还原反应;那么选项中提供的反应物要做还原剂,据此可以判断Zn→ Zn2+和H2→H2O的反应中均需要加入还原剂才能实现,而Cl2→Cl-需加入还原剂才能实现,CuO→CuCl2不属于氧化还原反应。
本题难度:简单
3、选择题 已知下列氧化剂都能氧化+4价硫元素,为了除去稀硫酸中混有的少量H2SO3,以得到纯净的稀硫酸,最合理的氧化剂是?
A?KmnO4 B?Ca(ClO)2? C?H2O2 ?D?Cl2?
参考答案:C
本题解析:C 用H2O2作氧化剂不会引入杂质。
本题难度:简单
4、选择题 从海水中提取溴,主要反应为:2Br-+Cl2=Br2+2Cl-,下列说法不正确的是
A.溴离子具有氧化性
B.氯气是还原剂
C.该反应属于复分解反应
D.氯气的氧化性比溴单质强
参考答案:ABC
本题解析:从该反应式看出,溴离子从-1价升高到0价,发生氧化反应,具有还原性,是还原剂;氯气从0价降低到-1价,发生还原反应,具有氧化性,是氧化剂;复分解反应的定义是由两种化合物互相交换成分,生成另外两种化合物的反应;由元素周期律的相关性质,氯气的氧化性比溴单质强。
点评:此题考核了氧化还原反应的判断,氧化剂还原剂的判断。
本题难度:简单
5、选择题 等质量的KClO3分别发生下述反应:
①有MnO2催化剂存在时,受热分解得到氧气;
②若不使用催化剂,加热至470℃左右,得到KClO4(高氯酸钾)和KCl。
下列关于①和②的说法不正确的是
[? ]
A.都属于氧化还原反应
B.发生还原反应的元素相同
C.发生氧化反应的元素不同
D.生成KCl的物质的量相同
参考答案:D
本题解析:
本题难度:简单