1、选择题 在相同温度和压强下,对反应CO2(g)+H2(g)  CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:

上述四种情况达到平衡后,n(CO)的大小顺序是( )
A.乙=丁>丙=甲
B.乙>丁>甲>丙
C.丁>乙>丙=甲
D.丁>丙>乙>甲
参考答案:A
本题解析:根据反应方程式:
CO2(g)+H2(g)  CO(g)+H2O(g)
CO(g)+H2O(g)
甲:? a mol?a mol?0 mol?0 mol
乙:? 2 a mol? a mol?0 mol?0 mol
丙:? 0 mol?0 mol ?a mol?a mol
丁:? a mol?0 mol?a mol?a mol
根据极端假设的思想,将产物全部转化为反应物,发现甲和丙中加入的物质的量一样,乙和丁中加入的物质的量一样,因此甲和丙、乙和丁属于等效平衡,达到平衡后CO的物质的量:甲=丙、乙=丁,乙和甲相比,乙相当于在甲的基础上多加了a mol CO2,增大反应物的浓度,平衡右移,因此达到平衡后CO的物质的量乙>甲,故n(CO)的大小顺序为:乙=丁>丙=甲。
本题难度:一般
2、填空题 已知可逆反应CO+H2O(g)  CO2+H2,达到平衡时,K=
CO2+H2,达到平衡时,K=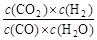 ,K是常数,只与温度有关,与浓度无关。
,K是常数,只与温度有关,与浓度无关。
(1)830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为?;K值为?。
(2)830K,若只将起始时c(H2O)改为6mol/L,则水蒸气的转化率为?。
(3)若830K时,起始浓度c(CO)=a mol/L,c(H2O)=b mol/L,H2的平衡浓度c(H2)=c mol/L,a、b、c之间的关系式是?。
参考答案:(1)40%,1(2)25%(3)C2=(a-c)(b-c)
本题解析:(1)平衡时CO的转化率为60%,则转化的浓度为1.2 mol/L,平衡时CO的浓度为0.8 mol/L ,;水蒸气的转化浓度为1.2 mol/L,转化率为1.2mol÷3mol/L×100%=40%;平衡时CO2和H2的浓度均为0.8 mol/L,故K值为1;(2)设此时各物质的转化浓度均为xmol/L,则平衡时,CO的浓度为(2-x)mol/L,水蒸气的浓度为(6-x)mol/L,二氧化碳和氢气的浓度均为xmol/L;因为K只与温度有关,故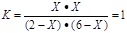 ,解得X=1.5,故水蒸气的转化率为1.5mol/L÷6mol/L×100%=25%;(3)因H2的平衡浓度c(H2)=c mol/L,故四种物质的转化浓度均为c mol/L,平衡时,CO的浓度为(a-c)mol/L,水蒸气的浓度为(b-c)mol/L,故
,解得X=1.5,故水蒸气的转化率为1.5mol/L÷6mol/L×100%=25%;(3)因H2的平衡浓度c(H2)=c mol/L,故四种物质的转化浓度均为c mol/L,平衡时,CO的浓度为(a-c)mol/L,水蒸气的浓度为(b-c)mol/L,故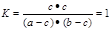 ,即C2=(a-c)(b-c)。
,即C2=(a-c)(b-c)。
点评:化学平衡是历年高考重中之重,考生一定要系统备考此知识点。难度较大。
本题难度:一般
3、选择题 一定温度下,可逆反应H2(g)+I2(g) 2HI(g)达到化学平衡状态的标志是(?)
2HI(g)达到化学平衡状态的标志是(?)
A.混合气体的压强不再变化
B.混合气体的颜色不再变化
C.反应速率v(H2)="0.5v" (HI)
D.c (H2):c(I2):c(HI)=1:1:2
参考答案:B
本题解析:判断一个反应是否达到平衡状态的实质是正逆反应速率相等,标志是所给条件是否从“变”达到“不变”。A该反应气体分子总数前后一样,故压强始终不变;B碘蒸气为紫色,随着反应的进行,容器内气体的颜色逐渐变浅;C反应速率之比始终与化学计量系数之比相等,故不能用于判断反应是否达到平衡状态;D各物质的浓度之比与化学计量系数之比相同,与反应是否达到平衡无关系。故答案选B。
点评:判断一个反应是否达到平衡状态,是历年高考的重点。考生在备考过程中应抓住实质、通过标志进行分析。难度中等,一般以选择题出现。
本题难度:一般
4、选择题 在2L的密闭容器中,发生3A(g)+B(g) 2C(g)的反应,若最初加入A和B都是4mol,测得10s内A的平均速率v(A)=0.12mol/(L·s),则反应进行到10s时容器中B的物质的量是
2C(g)的反应,若最初加入A和B都是4mol,测得10s内A的平均速率v(A)=0.12mol/(L·s),则反应进行到10s时容器中B的物质的量是
[? ]
A.1.6mol
B.2.8mol
C.3.2mol
D.3.6mol
参考答案:C
本题解析:
本题难度:简单
5、选择题 已知:CO2(g)+3H2(g)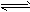 CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。一定条件下,向体积为1L的密闭容器中充入1 mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中,正确的是
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。一定条件下,向体积为1L的密闭容器中充入1 mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中,正确的是
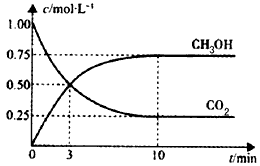
[? ]
A.升高温度能使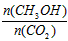 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率v(H2) =0. 075mol·L-1·min-1
参考答案:B
本题解析:
本题难度:一般