1、填空题 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略)。

①A常温下为黄绿色的气体单质。
②B为一种常见变价金属单质,在冷的浓硫酸中会被钝化。
③C的水溶液是一种无氧酸,且C的组成中含有与A相同的元素。
请回答:(1) A的化学式为?,构成非金属单质A的元素的最高价氧化物的分子式为?,C的名称为?。
(2)A与水反应的化学方程式为?。
(3)A与E反应生成D的离子方程式为?。
(4)在E的水溶液中加入足量氢氧化钠溶液,观察到的现象为?。
参考答案:(1) Cl2,Cl2O7,氯化氢 (2) Cl2 + H2O =" HCl" + HClO?(3)2Fe2++ Cl2 =2Fe3++ 2 Cl-
(4)有白色絮状沉淀生成,然后迅速变成灰绿色,最后变成红褐色沉淀。
本题解析:根据①可知A是氯气。由②可知B是铁。所以D是氯化铁,因此E是氯化亚铁,则C是氯化氢。
本题难度:一般
2、填空题 A、B、C、D四种中学化学常见的物质,其焰色反应均为黄色,试根据所给转化关系,回答下列问题:
①A
B+H2O+CO2↑
②D+H2O=C+O2↑
③B+Ca(OH)2=CaCO3↓+C
④A+C=B+H2O
(1)写出下列物质的化学式:
A______;B______;D______;
(2)完成下列反应式的书写:
转化①的化学方程式______;
转化④的离子方程式______.
参考答案:A、B、C、D四种中学化学常见的物质,其焰色反应均为黄色,均含有Na颜色,反应①分解生成B与水、二氧化碳,可知A为NaHCO3,B为Na2CO3,反应③碳酸钠与氢氧化钙反应生成碳酸钙与C,则C为NaOH,反应②D与水反应生成氧气与NaOH,则D为Na2O2,A能与NaOH反应生成碳酸钠与水,
(1)由上述分析可知,A为NaHCO3,B为Na2CO3,D为Na2O2,
故答案为:NaHCO3;Na2CO3;Na2O2;
(2)转化①的化学方程式为:2NaHCO3△.Na2CO3+CO2↑+H2O;
转化④的离子方程式为:OH-+HCO3-=CO32-+H2O,
故答案为:2NaHCO3△.Na2CO3+CO2↑+H2O;OH-+HCO3-=CO32-+H2O.
本题解析:
本题难度:简单
3、填空题 (14分)A、B、C、D、E、F为六种短周期元素,它们核电荷数依次递增,B、C、D在同一周期。已知:B原子有3个能级且各能级电子数相等;D原子最外能层P能级上有2个未成对电子,E是同周期元素中第一电离能最小的元素;F是同周期元素中原子半径最小的元素;A是非金属元素,且A、C、F可形成含配位键的离子化合物。请回答:
(1)A、D形成的三原子分子中心原子杂化类型是 ,分子空间构型为 。
(2)B、C、D氢化物稳定性由强到弱的顺序为 (用化学用语回答,下同),B、C、F最高价含氧酸酸性由强到的顺序为 ,B、C、D、E第一电离能由小到大的顺序为?;
(3)元素A、D、E形成的化合物分子式为? ?,其中含有的化学键类型有 ?。
(4)C的氢化物极易溶于D的常见氢化物,列出所有可能的原因? ?
参考答案:(1)SP3,V形。(各1分)?(2)H2O>NH3>CH4,? HClO4>HNO3>H2CO3 ,? Na<C<O<N(3)NaOH ,?离子键和(极性)共价键
(4)①氨分子与水分子间可形成氢键,②氨分子和水分子都是极性分子,③氨气与水可发生化学反应。
本题解析:A为H、B为C、C为N、D为O、E为Na、F为Cl
H2O为SP3杂化,V形,氢化物稳定性H2O>NH3>CH4B、C、F最高价含氧酸酸性HClO4>HNO3>H2CO3 , B、C、D、E第一电离能由小到大的顺序为Na<C<O<N
元素A、D、E形成的化合物分子式为NaOH ,? C的氢化物极易溶于D的常见氢化物,相似相溶,还有氨气可以和水反应。
本题难度:一般
4、简答题 图中B为日常生活中常见的金属,E是一种新型的清洁能源,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是生理盐水主要成分(图中部分反应物或生成物没有列出).
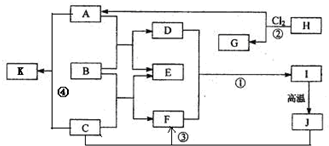
请按要求回答:
(1)写出B在周期表的位置第______周期______族,G的电子式______.
(2)反应①的离子方程式为______.
(3)反应②进行的条件是______,______.
(4)反应③的化学方程式为______.
参考答案:H、G是正四面体结构的非极性分子,H是一种重要的能源,则H为甲烷,由反应②可知G为CCl4,A为HCl;K是生理盐水主要成分,则K为NaCl,由反应④可知C为NaOH;B为金属,能与盐酸、与氢氧化钠反应,则B为Al,由框图中的转化可知E为氢气,D为氯化铝,F为偏铝酸钠,I为氢氧化铝,J为氧化铝;
(1)因B为铝,位于周期表中第三周期第ⅢA族,G为CCl4,其电子式为
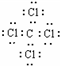
,故答案为:三;ⅢA;

;
(2)D为氯化铝,F为偏铝酸钠,则反应①的离子反应为Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(3)因烷烃的取代反应在光照条件下进行,为保证甲烷完全反应,则氯气应过量,故答案为:光照;过量Cl2;
(4)J为氧化铝,C为NaOH,则反应③的离子方程式为Al2O3+2NaOH═2NaAlO2+H2O,故答案为:Al2O3+2NaOH═2NaAlO2+H2O.
本题解析:
本题难度:一般
5、简答题 物质A是一种高熔点化合物,不溶于H2SO4、HNO3,却溶于HF,C是一种气体,D是白色沉淀,A、B、C、D之间的转化关系如图:
A是______?B是______
C是______?D是______.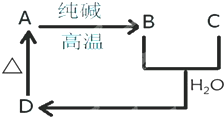
参考答案:物质A是一种高熔点化合物,不溶于H2SO4、HNO3,却溶于HF,可以推断A为SiO2,由A纯碱
本题解析:
本题难度:一般