1、选择题 X、Y、Z是位于不同周期的三种短周期元素,且原子序数逐渐增大,X、Z位于同一主族,三种元素可以形成原子个数比为1∶1∶1的化合物W。下列推测正确的是?( )。
A.元素Z的氧化物一定属于碱性氧化物
B.原子来源:91考试网 www.91eXam.org半径:X<Y<Z
C.三种元素中,Y的金属性最强
D.Y、Z都能形成含氧酸,且前者的酸性比后者强
参考答案:B
本题解析:“X、Y、Z是位于不同周期的三种短周期元素,且原子序数逐渐增大”,则X只能是H元素;“X、Z位于同一主族”,则Z为Na元素;“三种元素可以形成原子个数比为1∶1∶1的化合物W”,则Y为O元素。Na2O2不属于碱性氧化物,故A错误;原子半径:Na>O>H,B正确;三种元素中,Na的金属性最强,C错误;O元素和Na元素都不能形成含氧酸,D错误。
本题难度:一般
2、选择题 若aB2-与bAn+两种离子核外电子层结构相同,则a等于
A.b+n-2
B.b+n+2
C.b-n-2
D.b-n+2
参考答案:C
本题解析:
阳离子核外电子数=质子数-所带电荷数,所以bAn+的核外电子数为b-n;阴离子核外电子数=质子数+所带的电荷数,所以aB2-的核外电子数为a+2;aAn+与?bB2-两离子具有相同的电子层结构,说明二者核外电子数相同,所以b-n=a+2,即a=b-n-2,选C。
本题难度:一般
3、选择题 下列说法错误的是(?)
A.Na与Al为同周期元素,钠原子最外层有1个电子,铝原子最外层有3个电子,所以钠的金属性比铝强
B.Na与Mg为同周期元素,且Mg的核电荷数比Na的大,所以钠的金属性比镁强
C.NaOH为强碱,而Al(OH)3具有两性,所以钠的金属性比铝强
D.Zn+2Fe3+=Zn2++2Fe2+,所以Zn的金属性比Fe强
参考答案:D
本题解析:由反应Zn+Fe2+=Zn2++Fe才可说明Zn的金属性比Fe强。
本题难度:一般
4、填空题 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数。R是由A、D两元素形成的离子化合物,其中A+与D2一离子数之比为2:1。请回答下列问题:
(1)A元素形成的晶体内晶体类型应属于?(填写“六方”、“面心立方”或“体心立方”)堆积,空间利用率为?。
(2)C3-的电子排布式为?,在CB3分子中C元素原子的原子轨道发生的是?杂化,CB3分子的VSEPR模型为?。
(3)C的氢化物在水中的溶解度如何?,为什么具有这样的溶解性?。
(4)D元素与同周期相邻元素的第一电离能由大到小的关系是:?
(用元素符号表示);用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:?。
(5)如图所示是R形成的晶体的晶胞,该晶胞与CaF2晶胞结构相似,设晶体密度是p g·cm-3试计算R晶体中A+和D2-最短的距离?。
(阿伏加德罗常数用NA表示,只写出计算式,不用计算)
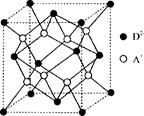
参考答案:23. (1)体心立方? 68%?(2)1s2 2s2 2p6? sp3?四面体形?
(3)l:700溶于水或极易溶于水?
氨分子和水分子间可以形成氢键,且氨分子和水分子均为极性分子,相似相溶,氨分子和水分子还可以发生反应,氨气极易溶于水。
(4)C1>P>S?;H2S+Cl2="2HCl+S"
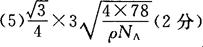
本题解析:B原子得一个电子填入3p轨道后,3p轨道已充满,故B为氯,A+比B-少一个电子层,故A为钠,C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,氮元素形成的氢化物氨气形成分子间氢键,使溶解度增大,故为N,;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等子中子数,故D为硫;(1)钠是体心立方密堆积,空间利用率为 68% ;(2)N3-有8个电子,最外层为全充满,故为1s2 2s2 2p6;NCl3形成三条单键和一对孤对电子,故为sp3杂化,是四面体形;(3)氨气极易溶于水,氨气分子间能形成分子间氢键,且和水均为极性分子,故在水中的溶解度很大;(4)同周期,从左向右整体第一电离能逐渐增大,与硫相邻的为磷和氯,但磷为半充满,稳定,第一电离能大,故C1>P>S;单质间的置换反应可以证明单质氧化性的强弱,故为:H2S+Cl2=2HCl+S;(5)该晶体中钠离子个数为8,硫离子有处于面上的和顶点上的,个数为4,晶胞的体积等于质量除以密度,质量为4个硫化钠的质量,由体积求出立方体的边长,四个硫和一个钠构成正四面体,钠位于正四面体的体心,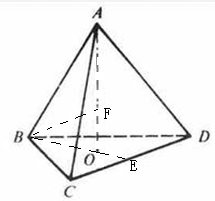 四面体的棱长为晶胞面对角线的一半,由边长求出棱长,根据棱长求出正三角形中BE的长,根据BO和OE的比值为2:1得出BO的长,根据AB和BO求出AO的长,根据三角形中的数量关系求出最短距离。
四面体的棱长为晶胞面对角线的一半,由边长求出棱长,根据棱长求出正三角形中BE的长,根据BO和OE的比值为2:1得出BO的长,根据AB和BO求出AO的长,根据三角形中的数量关系求出最短距离。
本题难度:一般
5、选择题 几种短周期元素的原子半径及主要化合价如下表:
元素代号
| X
| Y
| Z
| W
| V
|
原子半径/nm
| 0.090
| 0.118
| 0.075
| 0.073
| 0.102
|
主要化合价
| +2
| +3
| +5、+3、-3
| -2
| +6、-2
|
下列叙述不正确的是
A.X、Z、W位于同周期,Y与V位于同周期
B.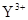 与
与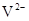 的核外电子数相等
的核外电子数相等
C.Y与W形成的化合物具有两性
D.Z的氢化物可与V的最高价氧化物的水溶液反应生成盐
参考答案:B
本题解析:短周期中,化合价有+6、—2价的元素必为S元素,即V为S元素;W为O元素;X为Be元素;Y为AL元素;Z为N元素;所以
A正确,X、Z、W位于同周期,第二周期;Y与V位于同周期,第三周期;
B错,AL3+离子核外有10个电子,S2—离子核外有18个电子;
C正确,Y与W形成的化合物为氧化铝,典型的两性氧化物;
D正确,Z的氢化物为NH3,V的最高价氧化物的水溶液为H2SO4;反应后生成硫酸铵;
本题难度:简单