1、选择题 可逆反应A(g)+B C(g)+D,A和C均为无色气体,当反应达到平衡时,下列叙述不正确的是(?)
C(g)+D,A和C均为无色气体,当反应达到平衡时,下列叙述不正确的是(?)
A.增大A的浓度,平衡体系颜色加深,则说明D是有颜色的气体
B.若升高温度,C的百分含量减少,则说明正反应为放热反应
C.若增大压强,平衡不移动,则说明B和D一定都是气体
D.如果B是气体,则增大A的浓度会使B的转化率增大,A的转化率减少
参考答案:C
本题解析:增大A的浓度,平衡体系颜色加深,而AC都为无色气体,所以D是有颜色的气体,故A正确;若升高温度,C的百分含量减少,根据勒夏特勒原理可以知道,正反应为放热反应,故B正确;若增大压强,平衡不移动,则说明B和D可以都是气体,也可以都是非气体,故C错误,为本题的答案;如果B是气体,则增大A的浓度,根据勒夏特勒原理可以知道,B的转化率增大,但是A的转化率减少,故D正确。
点评:本题考查了化学平衡移动的方向,该考点是高考考查的重点,本题难度适中,注意该题是要选择不正确的一项。
本题难度:简单
2、选择题 经一定时间后,可逆反应aA+bB 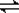 ?cC中物质的含量A%和C%随温度的变化曲线如图所示。下列说法正确的是( )
?cC中物质的含量A%和C%随温度的变化曲线如图所示。下列说法正确的是( )

A.该反应在T1、T3温度时达到化学平衡
B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应
D.升高温度,平衡会向正反应方向移动
参考答案:B
本题解析:由图可知当温度为T2时,反应达平衡状态,当温度再升高时,A的含量增多,C的含量减少,即可得该反应的正反应方向为放热反应;所以
A错,应温度为T2时达到化学平衡;B正确;C错,该反应的正反应方向为放热反应;D错,升高温度平衡向逆反应方向移动;
本题难度:简单
3、计算题 在127℃和1.0×105Pa时,向某容器中放入18.4gN2O4使之发生反应N2O4 2NO2并达到平衡,此时测得容器内混合气体的密度比原来减少1/3(温度和压强不变)。计算:
2NO2并达到平衡,此时测得容器内混合气体的密度比原来减少1/3(温度和压强不变)。计算:
(1)N2O4的分解率;
(2)平衡混合物的平均分子量。
参考答案:(1)N2O4的分解率为50%;
(2)平衡时混合气体的平均分子量为61.33。
本题解析:依题意nN2O4=(18.4g)/92g/mol=0.2mol
平衡混合气密度比原来减少1/3
∴(n起始/n平衡)=(ρ平衡/ρ起始)
=(2/3/1)=(2/3)
则有:n平衡=(3/2)n起始=(3/2)×0.2mol=0.3mol
(1)设N4O4分解率为x,则有:
N2O4 2NO2?Δn
2NO2?Δn
1?2?1
0.2xmol?(0.3mol-0.2mol)
解得?x=(0.1mol/0.2mol)=0.5=50%
(2)m总=18.4g
n总=0.3mol
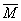 =(m总/n总)=(18.4/0.3)=61.33
=(m总/n总)=(18.4/0.3)=61.33
本题难度:简单
4、计算题 将相同物质的量的SO3充入下面的两个容器中,已知甲容器有活塞可以上下移动,乙容器体积固定,在相同的温度、压强下开始发生反应:2SO3(g) ?2SO2(g)+O2(g),在反应过程中维持体系温度不变。
?2SO2(g)+O2(g),在反应过程中维持体系温度不变。
(1)求达到平衡状态时SO3气体的转化率的大小关系?
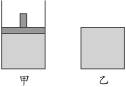 图2-2
图2-2
(2)达到平衡状态时分别充入一定量的Ar气,平衡是否会移动?会怎样移动?
参考答案:(1)甲容器中SO3的转化率比乙容器中SO3的转化率要大
(2)甲容器平衡向正反应方向移动,SO3的转化率增大,乙容器平衡不移动
本题解析:开始时两个容器中SO3的物质的量、体积、温度都是相等的,而且在反应过程中维持温度不变,即两个容器的温度始终是相同的,由于反应是一个气体分子数目增多的反应,所以对于乙容器来说,随着反应的不断进行其压强会逐渐增大,而甲容器随着气体分子数目的增多,活塞会逐渐向上移动,其体积会逐渐增大,所以乙容器相当于在A容器的基础上进行加压,而对于可逆反应2SO3(g) ?2SO2(g)+O2(g),加压会使得平衡向逆反应方向移动,这样会使转化率减小,所以达到平衡状态时甲容器中SO3的转化率比乙容器中SO3的转化率要大。
?2SO2(g)+O2(g),加压会使得平衡向逆反应方向移动,这样会使转化率减小,所以达到平衡状态时甲容器中SO3的转化率比乙容器中SO3的转化率要大。
当两个容器中都达到平衡状态后,再分别充入一定量的Ar气,乙容器由于体积没有改变,反应体系中各种物质的浓度并没有变化,正、逆反应速率仍然相等,所以其平衡不会移动。甲容器由于活塞的移动会导致体积增大,三种物质的浓度同等倍数减小,这和直接将活塞向上提一样,所以这时的情况相当于压强减小,其平衡向正反应(气体分子数目增多)方向移动,SO3的转化率要增大。
本题难度:简单
5、选择题 在某一密闭容器中,充入一定量的HI气体,发生反应2HI(g) 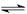 H2(g)+I2(g);△H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是
H2(g)+I2(g);△H>0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是

A? B? C? D
参考答案:A
本题解析:因为正反应是吸热反应,所以升高温度平衡向正反应方向移动,单质碘的含量升高,碘化氢的含量则是降低的,所以选项A正确,答案选A
本题难度:一般