1、选择题 一定量的锌粒与足量稀硫酸反应,向反应混合液中加入某些物质,下列判断正确的是
A.加入少量水,产生H速率减小,H2体积不变
B.加入NH4HSO4固体,产生H2速率不变,H2体积不变
C.加入CH3COONa固体,产生H2速率减小,H2体积减小
D.滴加少量CuSO4溶液,产生H2速率变大,H2体积减小
参考答案:AD
本题解析:A、加入少量水,减小了H+的浓度,锌粒的物质的量不变,则v(H2)减小,生成H2体积不变,故A正确;B、加入NH4HSO4固体,增大了H+的浓度,锌粒的物质的量不变,则反应速率加快,生成H2体积不变,故B错误;C、加入CH3COONa固体,结合生成弱酸醋酸,减小了H+的浓度,锌粒的物质的量不变,则v(H2)减小,生成H2体积不变,故C错误;D、滴加少量CuSO4溶液,锌置换出铜,从而构成Cu-Zn原电池,反应速率加快,锌粒的物质的量减少。则v(H2)增大,生成H2量减少,故D正确,答案选AD。
本题难度:一般
2、简答题 根据以下叙述,回答1~2小题.
1995年诺贝尔化学奖授予致力于研究臭氧层被破坏问题的三位环境化学家.大气中的臭氧层可滤除大量的紫外光,保护地球上的生物.氟利昂(如CCl2F2可在光的作用下分解,产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3).有关反应为:O3
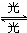
O2+O Cl+O3→ClO+O2 ClO+O→O2 总反应?2O3→3O2在上述臭氧变成氧气的反应过程中,Cl是( )
A.反应物
B.生成物
C.中间产物
D.催化剂
参考答案:总反应方程式2O3→3O2,臭氧是反应物,氧气是生成物.
A、该反应的反应物是O3,故A错误;
B、该反应的生成物是氧气,故B错误;
C、反应物中不含氯元素,氯原子不是中间产物,故C错误;
D、从反应历程看,第二、三两步反应氯原子在反应前后组成与质量都不变,所以是催化剂,故D正确;
故选D.
本题解析:
本题难度:一般
3、选择题 已知反应:2SO2+O2
2SO3,若反应速率分别用v(SO2)、v(O2)、v(SO3)表示,则下列关系正确的是( )
A.v(SO2)=v(O2)
B.v(SO2)=v(SO3)
C.v(O2)=v(SO3)
D.2v(SO2)=v(O2)
参考答案:对于反应2SO2+O2催化剂
本题解析:
本题难度:简单
4、选择题 一定量的锌与过量的稀H2SO4反应制取氢气,一定温度下为减慢反应速率而又不影响氢气的量,可向其 中加入
A.KCl固体
B.铁粉
C.K2SO4溶液
D.KNO3溶液
参考答案:C
本题解析:
本题难度:一般
5、计算题 在一定温度和压强下,有如下反应:2SO2(g)+O2 (g)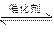 ?2SO3(g),将1.6 mol SO2和0.8 mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100 L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6 g·L-1。完成下列问题:
?2SO3(g),将1.6 mol SO2和0.8 mol的O2放入一体积可变的密闭容器中,测得容器的起始容积为100 L。经一段时间后,反应达到平衡,测得混合气体的密度为1.6 g·L-1。完成下列问题:
(1)达平衡时混合气体的体积为___________,SO2的转化率为___________;
(2)若起始时加入a mol SO2、b mol O2,且a∶b=2∶1,在同样温度和压强下,反应达到平衡时,测得混合气体的容积为120 L。则a、b的值分别为:a=_________,b=_________;
(3)若容器为体积不变的密闭容器,其容积为100 L。起始时加入x mol SO2、y mol O2和z mol SO3,反应达平衡时,温度和压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同。则x、y应该满足的关系式为________,x、z应该满足的关系式为_____________。
参考答案:(1)80 L 60%(2)? 2.4? 1.2
(3)x∶y=2∶1x+z=2
本题解析:(1)反应前后,气体总质量不变,则平衡时V(总)=
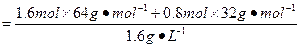 ="80" L。
="80" L。
2SO2(g)? +? O2 (g) 2SO3(g)
2SO3(g)
起始:1.6 mol? 0.8 mol? 0
转化:2x? x? 2x
平衡:1.6-2x? 0.8-x? 2x
因为: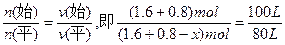 ,故x="0.48" mol,n(平)="1.92" mol。
,故x="0.48" mol,n(平)="1.92" mol。
α(SO2)=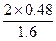 ×100%=60%
×100%=60%
(2)当保持温度、压强不变时,按n(SO2)∶n(O2)=2∶1通入a mol SO2和b mol O2,建立起等效平衡,则α(SO2)不变。因为a=2b,所以n(SO2)=2b。在(1)中n(平)="1.92" mol,在(2)时达到平衡时:
2SO2(g)+O2(g) 2SO3(g)?Δn
2SO3(g)?Δn
2? 1
2b·60%? 0.6b
n2(平)=3b-0.6b=2.4b
又知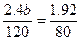 ,所以b=1.2,a=2.4
,所以b=1.2,a=2.4
(3)中x∶y=2∶1,x+z=2。
本题难度:简单