|
高考化学知识点总结《化学反应速率》高频试题巩固(2019年最新版)(四)
2019-06-25 21:33:35
【 大 中 小】
|
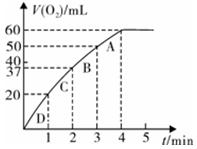
1、填空题 (11分)加入0.10 mol MnO2粉末于50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
①写出H2O2在二氧化锰作用下发生反应的化学方程式 。(2分)
②实验时放出气体的总体积是 mL。
③放出1/3气体所需时间为 min。
④反应放出3/4气体所需时间约为 min。
⑤A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。(2分)
⑥解释反应速率变化的原因 。(2分)
⑦计算H2O2的初始物质的量浓度_____________。(请保留两位有效数字)(2分)
参考答案:
①2H2O2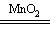 2H2O + O2↑;(2分) 2H2O + O2↑;(2分)
②60 mL ; ③1 min ; (各1分)
④2.5 min;(1分) ⑤D>C>B>A;(2分)
⑥随着反应的进行,浓度减小,反应速率减慢 (2分)
⑦0.11 mol·L-1;(2分)
本题解析:略
本题难度:简单
2、选择题 在一定条件下,向一带活塞的密闭容器中充入2mol?NO2,发生下列反应2NO2(g)?N2O4(g)△H<0,达到平衡状态后,在t1时刻改变条件,化学反应速率随时间变化关系如图.下列对t1时刻改变条件的推测中正确的是( )
A.保持压强不变,升高反应温度
B.保持温度和容器体积不变,充入1mol?N2(g)
C.保持温度和容器体积不变,充入1mol?N2O4?(g)
D.保持温度和压强不变,充入1mol?N2O4?(g)
| 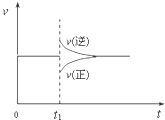
参考答案:A、该反应是放热反应,升高温度,正逆反应速率都增大,正逆反应速率曲线都在原直线上方,逆反应速率增大倍数大于正反应速率增大的倍数,导致平衡向逆反应方向移动,故A错误.
B、保持温度和容器体积不变,充入1molN2反应混合物的浓度不变,正逆反应速率不变,平衡不移动,故B错误.
C、保持温度和容器体积不变,充入1mol?N2O4,瞬间生成物的浓度增大,反应物的浓度不变,逆反应速率增大,正反应速率不变,所以逆反应速率大于正反应速率,正反应速率与原速率有接触点,故C错误.
D、保持温度和压强不变,充入1molN2O4(g)的瞬间,生成物的浓度增大,容器的体积增大,导致反应物的浓度减小,逆反应速率增大,正反应速率降低,平衡向逆反应移动,故D正确.
故选:D.
本题解析:
本题难度:一般
3、填空题 向某密闭容器中加入0.15 mol/L A、0.05 mol/L C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图中甲图所示[t0时c(B)未画出,t1时增大到0.05 mol/L]。乙图为t2时刻后改变反应条件,平衡体系中正、逆反应速率随时间变化的情况。

(1)若t4时改变的条件为减小压强,则B的起始物质的量浓度为_____mol/L。
(2)若t5时改变的条件是升温,此时v(正)>v(逆),若A的物质的量减少0.03 mol时,容器与外界的热交换总量为akJ,写出该反应的热化学方程式_______。
(3)若t1=15s,则t0~t1阶段以C浓度变化表示的平均反应速率为v(C)=_______ mol/L,A的转化率为________。
(4)t3时改变的某一反应条件可能是________(选填序号)。
a.使用催化剂
b.增大压强
c.增大反应物浓度
参考答案:(1)0.02
(2)3A(g) 2C(g)+B(g) ΔH=+100a kJ·mol-1 2C(g)+B(g) ΔH=+100a kJ·mol-1
(3)0.004 60% (4)a、b
本题解析:这是一道反应速率及其影响因素与平衡移动的综合性题目。
(1)t4时,减小压强,v(正)、v(逆)以同等倍数下降,说明反应前后化学计量数之和相等,由A、C浓度变化曲线知,到t1时,A、C的浓度变化量为Δc(A)=0.15-0.06=0.09(mol·L-1),Δc(C)=0.11-0.05=0.06(mol·L-1),即A、C的化学计量数之比为0.09∶0.06=3∶2,故反应式为3A(g) 2C(g)+B(g),则B的起始浓度为0.05-0.03=0.02(mol·L-1)。 2C(g)+B(g),则B的起始浓度为0.05-0.03=0.02(mol·L-1)。
(2)因升温,v(正)>v(逆),平衡正向进行,故此反应为吸热反应,其热化学反应方程式为3A(g) 2C(g)+B(g) 2C(g)+B(g)
ΔH=+100a kJ·mol-1。
(3)v(C)=?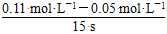 =0.004 mol·L-1·s-1 =0.004 mol·L-1·s-1
α(A)=? ×100%=60%。 ×100%=60%。
(4)乙图中t3时刻v(正)、v(逆)以同等倍数增大,故应是增大压强或加入催化剂。
本题难度:一般
4、选择题 在一定条件下,将A2和B2两种气体通入1 L密闭容器中,反应按下式进行:xA2(g)+yB2(g)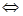 2C(g),两秒钟后反应速率如下:v(A2)="0.4" mol·L-1·s-1,v(B2)="1.2" mol·L-1·s-1,v(C)="0.8" mol·L-1·s-1,则该x和y的值分别为( ) 2C(g),两秒钟后反应速率如下:v(A2)="0.4" mol·L-1·s-1,v(B2)="1.2" mol·L-1·s-1,v(C)="0.8" mol·L-1·s-1,则该x和y的值分别为( )
A.2和3? B.3和2? C.3和1? D.1和3
参考答案:D
本题解析:对于可逆反应来说,在同一时刻各物质的速率比等于方程式的系数比。
本题难度:一般
5、实验题 控制变量法是研究化学变化规律的重要思想方法。请仔细观察下表中50ml稀盐酸和1g碳酸钙反应的实验数据:
实验
序号
| 碳酸钙状态
| c(HCl)/mol·L-1
| 溶液温度/oC
| 碳酸钙消失时间/s
| 反应前
| 反应后
| 1
| 粒状
| 0.5
| 20
| 39
| 400
| 2
| 粉末
| 0.5
| 20
| 40
| 60
| 3
| 粒状
| 0.6
| 20
| 41
| 280
| 4
| 粒状
| 0.8
| 20
| 40
| 200
| 5
| 粉末
| 0.8
| 20
| 40
| 30
| 6
| 粒状
| 1.0
| 20
| 40
| 120
| 7
| 粒状
| 1.0
| 30
| 50
| 40
| 8
| 粒状
| 1.2
| 20
| 40
| 90
| 9
| 粒状
| 1.2
| 25
| 45
| 40
|
分析并回答下列问题:
(1)本反应属于__________反应(填“吸热”或“放热”),反应的离子方程式_____________。
(2)实验6和7表明,___________对反应速率有影响,__________反应速率越快,能表明同一规律的实验还有_____________(填实验序号)。
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是_____________________。
(4)本实验中影响反应速率的其它因素还有________________,能表明这一规律的实验序号是1、2与____________。
参考答案:(1)放热;CaCO3+2H+===Ca2++CO2↑+H2O;
(2)反应温度;气体条件不变,温度越高;8和9;
(3)反应物浓度越大,反应速率越快;
(4)反应物状态;4和5。
本题解析:(1)通过表中数据,对比反应前后温度变化可知,反应后溶液温度升高,则反应为放热反应,反应的离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O;
(2)由实验6和7、8和9的实验数据可知,温度越高,碳酸钙消失的时间越少,说明温度越高,反应速率越大,,能表明同一规律的实验还有8和9;
(3)实验1、3、4、6、8相同的地方是固体的形状相同,反应前的温度相同,但反应物的浓度依次增大,碳酸钙消失的时间以此减少,说明反应物浓度越大,反应速率越快;
(4)1、2与4、5两组数据反应温度相同,盐酸的浓度相同,但固体的形状不同,实验数据标明粉末时的反应速率大于粒状,则可说明接触面积越大,反应速率越大,能表明这一规律的实验序号是1、2与4和5。
本题难度:一般
| 