1、选择题 实验中要快速制取氢气,最好的方法是( )
A.纯锌和稀硫酸反应
B.纯锌和浓硫酸反应
C.粗锌和浓硫酸反应
D.粗锌(含铅铜杂质)与稀硫酸反应
参考答案:纯锌与稀硫酸反应速率较粗锌慢,故A错误、D正确,因粗锌可与稀硫酸形成原电池反应;无论是粗锌还是纯锌,与浓硫酸反应都不能生成氢气,浓硫酸具有强氧化性,可生成二氧化硫气体,故B、C错误.
故选D.
本题解析:
本题难度:一般
2、实验题 (10分)某同学想利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响。部分实验用表如下:
实验
编号
| 温度/K
| 盐酸浓度
/mol·L-1
| 醋酸浓度/mol·L-1
| 实验目的
|
①
| 298
| 0.20
| ?
| a.实验①和②,探究温度对反应速率的影响;
b.实验①和③,探究浓度对反应速率的影响;
c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些。
|
②
| 308
| 0.20
| ?
|
③
| 298
| 0.40
| ?
|
④
| ?
| 0.20
| 0.20
|
⑤
| ?
| ?
| ?
|
(1)请完成上工作表(填写实验④⑤的空格)。
(2)上表实验①中,镁条消失的时间为20s。实验过程中,镁条剩余质量与时间关系如图:
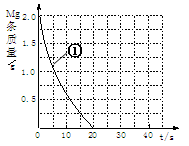
Ⅰ假设反应过程中盐酸体积不变,则要计算该反应的速率v(HCl),尚缺少的数据是???。
Ⅱ若反应温度每升高10℃,反应速率增大到原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在图中大致画出“实验②”、“实验④中醋酸实验”的镁条质量与时间关系曲线,并用②或④注明曲线代表的实验(假设实验中所用镁完全相同,且镁均能完全溶解)。
参考答案:(1)④ 298或308;⑤ 308或298,0.20,0.20 (4分)
(2)Ⅰ. 盐酸的体积。(2分)
Ⅱ. 曲线②,起点同①,终点在横坐标10处;(2分)
曲线④,应根据第⑷小题表中填写的温度确定,若为298K,则终点在横坐标40处;若为308K,则曲线与①重合,只要注明实验标号即可。(2分)
本题解析:确实盐酸的体积无法求算出盐酸的速率,应根据第⑷小题表中填写的温度确定,若为298K,则终点在横坐标40处;若为308K,则曲线与①重合,因为镁都溶解不同的酸醋酸的速率小于盐酸。
本题难度:一般
3、填空题 某同学探究外界条件对H2O2分解速率的影响,所用H2O2浓度为5%、10%,实验温度为20℃、40℃,其他试剂有1mol/LFeCl3溶液.每次实验H2O2的用量为2mL,FeCl3溶液2滴.
(1)请完成以下实验设计表:
| 实验编号 | 温度/℃ | H2O2浓度/% | 其它试剂 | 实验目的
①
20
5
无 | (Ⅰ)实验①和②探究催化剂对H2O2分解速率的影响;
(Ⅱ)实验②和③探究温度对该反应速率的影响;
(Ⅲ)实验②和④探究H2O2浓度对该反应速率的影响.
②
20
5
FeCl3溶液
③
______
______
______
④
______
______
______
|
(2)实验④产生气泡的速率比实验②快.分析引起反应速率差异的原因是______.
(3)废旧印刷电路板的回收利用可实现资源再生.经粉碎分离,能得到非金属粉末和金属粉末.用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜,溶液变成蓝色,写出发生反应的化学方程式:______.
控制其它条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol/LH2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80
铜的平均溶解速率
(×10-3mol/(L?min))
7.34
8.01
9.25
7.98
7.24
6.73
5.76
|
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是:______.
参考答案:(1)③、实验②和③探究温度对该反应速率的影响,故②③的温度不同,其他条件完全相同;
④、实验②和④探究H2O2浓度对该反应速率的影响,故②和④的H2O2浓度不同,其他条件相同;
故答案为:
③405FeCl3溶液(2分)④2010FeCl3溶液(2分)(2)实验④产生气泡的速率比实验②快,引起反应速率差异的原因是:其他条件相同时,H2O2浓度增大,分解速率加快;
故答案为:其他条件相同时,H2O2浓度增大,分解速率加快;
(3)铜与H2O2和H2SO4反应生成了硫酸铜,反应方程式是:Cu+H2O2+H2SO4 △.CuSO4+2H2O;由于温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小;
故答案为:Cu+H2O2+H2SO4 △.CuSO4+2H2O;温度高于40℃后,随着温度的升高,H2O2的分解速率加快,使溶液中H2O2的浓度降低加快,对铜的溶解速率的影响超过了温度升高对铜溶解速率的影响,所以铜的溶解速率逐渐减小.
本题解析:
本题难度:一般
4、选择题 一定温度下,某密闭容器中发生反应:2HI(g) ?H2(g)+I2(g)?△H>0,若15s内c(HI)由0.1 mol·L-1降到0.07 mol·L-1,则下列说法正确的是
?H2(g)+I2(g)?△H>0,若15s内c(HI)由0.1 mol·L-1降到0.07 mol·L-1,则下列说法正确的是
A.15s内用H2表示的平均反应速率为v(H2)="0.002" mol·L-1·s-1
B.升高温度平衡逆向移动
C.c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需时间为10s
D.减小反应体系的体积,化学反应速率加快
参考答案:B
本题解析:A、加水稀释, 促进NH4+ 和Fe2+水解,浓度减小,SO42—浓度减小。(NH4)2Fe(SO4)2溶液水解显酸性,加水稀释,H+浓度减小,OH—增大;B、Na2SO4溶液呈中性,加水稀释,Na+和SO42—浓度减小,H+和OH—都不变;C、氨水溶液显碱性,加水稀释,OH—浓度减小,H+增大;D、NaHSO4溶液显酸性,加水稀释,H+浓度减小,OH—增大
本题难度:一般
5、计算题 把2.5 mol A和2.5 molB两种气体混合放入容积为2L的密闭容器里发生反应3A(g)+B(g) XC(g)+2D(g),经5S后反应达到平衡,在此5S内C的平均反应速率为0.2mol/(L· s),同时生成1 mol D,试求:
XC(g)+2D(g),经5S后反应达到平衡,在此5S内C的平均反应速率为0.2mol/(L· s),同时生成1 mol D,试求:
⑴在此5S内D的平均反应速率。
⑵计算X的值
参考答案:5S内C的平均反应速率为0.2mol/(L· s)
所以生成C的物质的量是0.2mol/(L· s)×2L×5s=2.0mol
因为物质的变化量之比是相应的化学计量数之比
所以X=4
又因为速率之比是相应的化学计量数之比
所以5S内D的平均反应速率0.2mol/(L· s)÷2=0.1mol/(L· s)
本题解析:考查可逆反应的有关计算。
本题难度:一般