1、选择题 把下列4种X溶液分别加入4个盛有10?mL?2?mol/L盐酸的烧杯中,均加入水稀释到50?mL,此时,X和盐酸缓慢地进行反应,其中反应速率最快的是
[? ]
A.10℃20?mL?3?mol/L的X溶液 ?
B.20℃30?mL?2?mol/L的X溶液 ?
C.20℃10?mL 4?mol/L的X溶液 ?
D.10℃20?mL?2?mol/L的X溶液
参考答案:B
本题解析:
本题难度:一般
2、选择题 已知反应4NH3+5O2 4NO+6H2O,若在反应开始后5s~10s之间的反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列判断正确的关系是( )。
4NO+6H2O,若在反应开始后5s~10s之间的反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列判断正确的关系是( )。
A.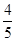 v(NH3)=v(O2)
v(NH3)=v(O2)
B.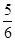 v(O2)=v(H2O)
v(O2)=v(H2O)
C. v(NH3)=v(H2O)
v(NH3)=v(H2O)
D.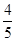 v(O2)=v(NO)
v(O2)=v(NO)
参考答案:D
本题解析:根据反应速率之比是相应的化学计量数之比可知,v(H2O)=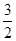 ?v(NH3)=
?v(NH3)=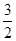 v(NO)= v(O2),所以选项D正确,答案选D。
v(NO)= v(O2),所以选项D正确,答案选D。
本题难度:一般
3、实验题 工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
CH3COOH(l)+C2H5OH(l) CH3COOC2H5(l)+H2O(l)?ΔH=-8.62kJ·mol-1
CH3COOC2H5(l)+H2O(l)?ΔH=-8.62kJ·mol-1
已知CH3COOH、C2H5OH和CH3COOC2H5的沸点依次为118℃、78℃和77℃。在其他条件相同时,某研究小组进行了多次实验,实验结果如图所示。
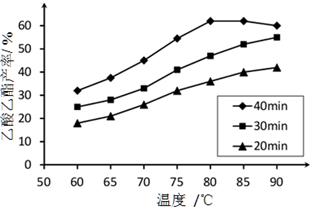
(1)该研究小组的实验目的是__________________。
(2)60℃下反应40min与70℃下反应20min相比,前者的平均反应速率___________后者(填“小于”、“等于”或“大于”)。
(3)如图所示,反应时间为40min、温度超过80℃时,乙酸乙酯产率下降的原因可能是______(写出两条)。
(4)某温度下,将0.10 mol CH3COOH溶于水配成1 L溶液。
①实验测得已电离的醋酸分子占原有醋酸分子总数的1.3%,则该温度下CH3COOH的电离平衡常数K=____________________。(水的电离忽略不计,醋酸电离对醋酸分子浓度的影响忽略不计)
②向该溶液中再加入__________mol CH3COONa可使溶液的pH约为4。(溶液体积变化忽略不计)
参考答案:(10分)
(1)探究反应温度、反应时间对乙酸乙酯产率的影响 (2分)
(自变量、因变量有遗漏或表达不清,扣1分)
(2)小于(2分)(“<”得1分)
(3)反应可能已达平衡状态,温度升高平衡向逆反应方向移动;温度过高,乙醇和乙酸大量挥发使反应物利用率下降(2分)
(4)①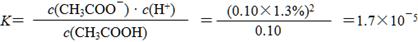 (2分)
(2分)
(因计算时未作近似处理使小数在1.69~1.71之间均不扣分)
②1.7×10-2?(2分)
(“1.69×10-2~1.71×10-2”或用小数表示均不扣分)
本题解析:(1)根据图中信息可以得出此实验的目的是探究反应温度、反应时间对乙酸乙酯产率的影响。
(2)温度越高,反应速率越大,故前者的平均反应速率小于后者。
(3)ΔH=-8.62kJ·mol-1,即反应为放热反应,达到平衡时化学反应逆向移动。故乙酸乙酯产率下降的原因可能是反应可能已达平衡状态,温度升高平衡向逆反应方向移动;温度过高,乙醇和乙酸大量挥发使反应物利用率下降。
(4)①经过公式计算得: 。
。
点评:本题考查的是化学反应速率的影响因素、化学平衡移动和电离平衡常数计算的知识,题目难度较大,考查学生对基础知识的掌握和计算的能力。
本题难度:一般
4、选择题 在可逆反应CO(g)+H2O(g)  CO2(g)+H2(g)(正反应为放热反应)中,改变下列条件,不能使v正增大的是( )。
CO2(g)+H2(g)(正反应为放热反应)中,改变下列条件,不能使v正增大的是( )。
A.升高温度
B.降低温度
C.使用催化剂
D.增大CO浓度
参考答案:B
本题解析:不论反应是放热还是吸热,升高温度会增大反应速率,而降低温度会减慢反应速率;增大反应物浓度,加快反应速率。
本题难度:一般
5、实验题 (5分)某实验小组对H2O2的分解做了如下探究:
(1)下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据:
用10ml H2O2制取150ml(标准状况下)O2所需的时间(s)
反应条件
时间(s)
反应条件
时间(s)
浓度
|
30%H2O2
|
15%H2O2
|
10%H2O2
|
5%H2O2
|
无催化剂、不加热
| 几乎不反应
| 几乎不反应
| 几乎不反应
| 几乎不反应
|
无催化剂、加热
| 360
| 480
| t
| 720
|
MnO2催化剂、加热
| 10
| 25
| 60
| 120
|
①该实验小组在设计方案时,考虑了浓度、 、 等因素对H2O2分解速率的影响。
 ②推测t的范围为 。
②推测t的范围为 。
(2)将质量相同但聚集状态不同的MnO2分别加入15 ml 5%的H2O2溶液中,并用带火星的木条测试,结果如下:
催化剂(MnO2)
| 操作情况
| 观察结果
| 反应完成所需的时间
|
粉末状
| 混合不振荡
| 剧烈反应,带火星的木条复燃
| 3.5min
|
块状
| 反应较慢,火星红亮但木条未复燃
| 30min
|
①写出上述实验中发生反应的化学方程式:
②实验结果表明,催化剂的催化效果与 有关。
参考答案:(1)①温度、催化剂②480<t<720 ①2H2O2=2H2O+O2↑②催化剂的颗粒大小
本题解析:考查外界条件对反应速率的影响
(1)根据表中的实验数据可判断,在设计实验方案时考虑了浓度、温度和催化剂等对反应速率的影响。因为浓度越大,反应速率越快,所以10%的双氧水分解生成相同的氧气时小于的时间要大于15%的双氧水,而小于5%的双氧水,即480<t<720。
(2)双氧水不稳定,加热分解生成氧气和水,反应式为2H2O2=2H2O+O2↑。根据实验现象可判断粉末状的催化剂催化效果好,这说明催化剂的催化效果与催化剂的颗粒大小有关系。
本题难度:一般