1、选择题 常温下,2.0×10-3mol?L-1氢氟酸的水溶液中,调节溶液pH(忽略溶液体积变化)得到的[HF]、[F-]与溶液pH的变化关系如下图.下列叙述不正确的是( )
(提示:Ka(CH3COOH)=1.8×10-5mol?L-1,Ksp(CaF2)=1.5×10-10mol3?L-3)
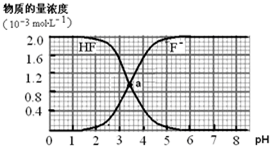
A.两条曲线交点a对应溶液的[F-]=[HF]
B.加入NaOH溶液至pH=7,溶液中[F-]=[Na+]
C.常温下HF的电离常数Ka(HF)>Ka(CH3COOH)
D.pH=4时,加入CaCl2固体使[Ca2+]=2.0×10-3mol?L-1,无CaF2沉淀析出
参考答案:A、纵轴是微粒浓度,横轴是溶液PH,两条曲线交点a对应溶液的[F-]=[HF],故A正确;
B、加入NaOH溶液反应HF+NaOH=NaF+H2O;溶液中存在电荷守恒,c(Na+)+c(H+)=c(OH-)+c(F-),至pH=7,c(H+)=c(OH-),溶液中[F-]=[Na+],故B正确;
C、Ka=c(H+)c(F-)c(HF);当c(F-)=C(HF)时,Ka=c(H+)=10-3.5=3.5×10-4mol?L-1>Ka(CH3COOH)=1.8×10-5mol?L-1,常温下HF的电离常数Ka(HF)>Ka(CH3COOH),故C正确;
D、分析图象当PH=4.0,溶液中的F-离子浓度1.6×10-3mol;加入CaCl2固体使c(Ca2+)=2.0×10-3mol?L-1,c(Ca2+)×c2(F-)=2.0×10-3mol?L-1×(1.6×10-3)2=5.1×10-10>Ksp(CaF2),有沉淀生成,故D错误;
故选D.
本题解析:
本题难度:简单
2、选择题 已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是( )
A.Mg2++2HCO3-+2Ca2++4OH-═Mg(OH)2↓+2CaCO3↓+2H2O
B.Cu2++H2S═CuS↓+2H+
C.Zn2++S2-+2H2O═Zn(OH)2↓+H2S↑
D.FeS+2H+═Fe2++H2S↑
参考答案:A.由于溶解度MgCO3>Mg(OH)2,则反应生成Mg(OH)2和CaCO3,故A正确;
B.由于电离出S2-的能力H2S>CuS,则Cu2+与H2S反应生成CuS,离子方程式正确,故B正确;
C.因ZnS比Zn(OH)2难溶,S2-和Zn2+应先结合成ZnS沉淀,而不是双水解,故C错误;
D.由于电离出S2-的能力FeS>H2S,FeS溶于酸可生成H2S,故D正确.
故选:C.
本题解析:
本题难度:简单
3、选择题 下列化学原理的应用,主要用沉淀溶解平衡原理来解释的是( )
①热纯碱溶液的洗涤油污能力强;
②误将钡盐[BaCl2、Ba(NO3)2]当作食盐食用时,常用0.5%的Na2SO4溶液解毒;
③溶洞、珊瑚的形成;
④碳酸钡不能做“钡餐”而硫酸钡则能;
⑤泡沫灭火器灭火的原理.
A.②③④
B.①②③
C.③④⑤
D.①②③④⑤
参考答案:①碳酸钠是强碱弱酸盐,因为水解使其溶液呈碱性,碱能促进油脂水解,所以热纯碱溶液的洗涤油污能力强,应用了盐类水解原理,故不符合;
②钡离子有毒,所以可溶性的钡盐有毒,钡离子和硫酸根离子反应生成不溶于酸和水的硫酸钡,即易溶性的物质能向难溶性的物质转化,所以可以用沉淀溶解平衡原理来解释;
③水中含有钙离子,空气中有二氧化碳,二氧化碳和水反应生成碳酸,碳酸和钙离子反应生成难溶性的碳酸钙,长时间反应,形成溶洞珊瑚,所以可以用沉淀平衡原理来解释;
④碳酸钡能和盐酸反应生成氯化钡和二氧化碳、水,硫酸钡和盐酸不反应,所以碳酸钡不能做“钡餐”而硫酸钡则能,可以用沉淀平衡原理来解释;
⑤碳酸氢钠水解使其溶液呈碱性,硫酸铝水解使其溶液呈酸性,氢离子和氢氧根离子反应生成水,则碳酸氢钠和硫酸铝相互促进水解,从而迅速的产生二氧化碳,所以可以用盐类水解原理来解释泡沫灭火器灭火的原理,故不符合;
故选A.
本题解析:
本题难度:简单
4、选择题 下表提供的玻璃仪器(非玻璃仪器任选)及现象描述均符合相应实脸目的的是
选项
| 实验目的
| 玻璃仪器
| 实验现象
|
A
| 硫化锌沉淀转化为硫化铜沉淀
| 试管、胶头滴管
| 白色沉淀转化为黑色沉淀
|
B
| 验证CO2的氧化性
| 酒精灯、集气瓶、玻璃片
| 镁条剧烈燃烧,产生白色的烟雾,瓶内壁有白色粉末
|
C
| 分离乙酸乙酯与乙酸
| 分液漏斗、烧杯
| 液体分层,上层为无色油状液体,上层液体和下层液体都从分液漏斗下口放出
|
D
| 实验室制取乙烯
| 酒精灯、圆底烧瓶、导管
| 加热后液体沸腾,液体逐渐变黑,并有气体产生
|
参考答案:A
本题解析:A.ZnS白色沉淀在溶液中存在沉淀溶解平衡:ZnS(s) Zn2+(aq)+S2-(aq),当向该溶液中滴加CuSO4溶液,由于c(Cu2+)?c(S2-)>Ksp(CuS),所以会转化为更难溶的CuS黑色沉淀,正确;B.镁条在CO2中剧烈燃烧,发出耀眼的白光,产生白烟,而不是白色烟雾,瓶内壁附有白色粉末和黑色颗粒,错误;C. 乙酸乙酯与乙酸是混溶的液体物质,向乙酸乙酯与乙酸中加入饱和碳酸钠溶液,振荡、静置、分液,上层的乙酸乙酯应从分液漏斗上口放出,错误;D.实验室制乙烯需将浓硫酸与乙醇混合加热170℃,因此需要的玻璃仪器中缺少温度计,错误。
Zn2+(aq)+S2-(aq),当向该溶液中滴加CuSO4溶液,由于c(Cu2+)?c(S2-)>Ksp(CuS),所以会转化为更难溶的CuS黑色沉淀,正确;B.镁条在CO2中剧烈燃烧,发出耀眼的白光,产生白烟,而不是白色烟雾,瓶内壁附有白色粉末和黑色颗粒,错误;C. 乙酸乙酯与乙酸是混溶的液体物质,向乙酸乙酯与乙酸中加入饱和碳酸钠溶液,振荡、静置、分液,上层的乙酸乙酯应从分液漏斗上口放出,错误;D.实验室制乙烯需将浓硫酸与乙醇混合加热170℃,因此需要的玻璃仪器中缺少温度计,错误。
考点:考查实验方案的设计的正误判断的知识。
本题难度:一般
5、填空题 (12分)水泥是一种重要的建筑材料,水泥的强度是评价水泥质量的重要指标,它与水泥中CaO的含量有着良好的相关性,因此在特殊情况下可以通过测定其中Ca0的含量预测水泥的强度。为测量某品牌水泥中氧化钙的含量,进行如下实验:
步骤1:熔样:准确称取0.3000g试样置于坩埚中,高温灼烧5分钟后,冷却并研碎,加入2.000g无水碳酸钠混匀后,再高温灼烧10分钟。
步骤2:酸溶:取冷却后的烧结块,加入40mL水后,再加入l0mL稀盐酸和3滴稀硝酸。
步骤3:除杂:在酸溶后所得溶液中慢慢滴加稀氨水使其中的Fe3+、Al3+转化为沉淀,过滤。
步骤4:沉淀:在滤液中加入草酸铵溶液,加热煮沸后,边搅拌边滴加氨水至弱碱性,静置。
步骤5:溶解:将生成的草酸钙( CaC2O4)沉淀加入到稀硫酸中,加热并搅拌使其完全溶解。
步骤6:滴定:用0.1000 mol·L-1的KMnO4溶液进行滴定至微红色出现并保持30s不消失,共用去KMnO4溶液13.000mL。反应的化学方程式为:2 KMnO4+5 H2C2O4+3H2SO4= K2SO4+2MnSO4+5CO2↑+8H2O
(1)写出步骤3中Al3+转化为沉淀的离子方程式: ;
(2)已知室温下Al(OH)3的Ksp=1.0×10-33,欲使溶液中c(Al3+)≤l.0xl0-6mol·L-1,pH≥ ;
(3)通过计算确定该试样中氧化钙的质量分数(写出计算过程)。
参考答案:(1)Al3++3NH3?H2O=Al(OH)3↓+3NH4+ (2) 5 (3) 60.7%
本题解析:(1)稀氨水能与Al3+反应生成氢氧化铝沉淀和铵根离子:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(2)欲使溶液中c(Al3+)≤l.0×l0-6mol?L-1,C(OH-)≥ =
= =l.0×l0-9mol?L-1,
=l.0×l0-9mol?L-1,
c(H+)≥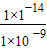 mol?L-1=l.0×l0-5mol?L-1,所以pH≥5,答案为:5.
mol?L-1=l.0×l0-5mol?L-1,所以pH≥5,答案为:5.
(3)5CaO~ 5CaC2O4 ~ 2KMnO4
5×56g 2mol
m(CaO) 0.1000mol?L-1×0.013L
 解得:m(CaO)=0.182g,氧化钙的质量分数为:
解得:m(CaO)=0.182g,氧化钙的质量分数为: ×100%=60.7%,答案为:氧化钙的质量分数为60.7%.
×100%=60.7%,答案为:氧化钙的质量分数为60.7%.
考点:考查沉淀溶解平衡的计算,利用化学方程式的计算等知识。
本题难度:困难