|
|
|
高考化学知识点总结《原电池原理》试题巩固(2019年最新版)(三)
2019-06-25 21:38:03
【 大 中 小】
|
1、选择题 新型NaBH4/H2O2燃料电池(DBFC)的结构如图,有关该电池的说法正确是
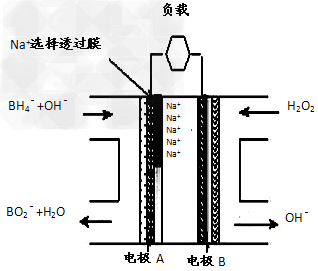
[? ]
A.电子从B电极经外电路流向A电极
B.电池负极区的电极反应为: BH?+8OH-―8e-=BO?+6H2O
C.放电过程中,Na+从正极区向负极区迁移
D.在电池反应中,每消耗1L?6?mol/LH2O2溶液,理论上流过电路中的电子为6NA个
2、填空题 甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景。
(1)工业生产甲醇的常用方法是:CO(g)+2H2(g)  ?CH3OH(g)? △H = —90.8kJ/mol。 ?CH3OH(g)? △H = —90.8kJ/mol。
已知:2H2(g)+O2(g)=2H2O(l)? △H = —571.6kJ/mol;
H2(g)+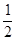 O2(g)=H2O(g)? △H = —241.8kJ/mol; O2(g)=H2O(g)? △H = —241.8kJ/mol;
2CO(g)+O2(g)=2CO2(g)? △H = —566.0kJ/mol
CH3OH(g) = CH3OH(l)? △H = —37.3kJ/mol
①计算液体CH3OH的燃烧热为???。
②若在恒温恒容的容器内进行反应CO(g)+2H2(g)  ?CH3OH(g),下列表示该反应达到平衡状态的标志有???(填字母序号)。 ?CH3OH(g),下列表示该反应达到平衡状态的标志有???(填字母序号)。
A.有1个H—H键生成的同时有 3个C—H键生成
B.CO百分含量保持不变
C.容器中混合气体的压强不变化
D.容器中混合气体的密度不变化
| (2)制甲醇所需要的H2,可用下列反应制取:H2O(g)+CO(g)  H2(g)+ CO2(g)?△H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,试回答下列问题: H2(g)+ CO2(g)?△H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,试回答下列问题:
①该温度下,反应进行一阶段时间后,测得H2的浓度为0.5mol?L-1,则此时该反应v(正)?v(逆)(填“>”、“<”或“=”);
②若反应温度不变,达到平衡后,H2O的转化率为?。
(3)某实验小组设计了如右图7所示的甲醇燃料电池装置。
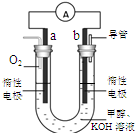
①该电池工作时,OH— 向??极移动(填“a”或“b”);
②工作一段时间后,测得溶液的pH减小,该电池负极反应的离子方程式为?。
3、填空题 某原电池装置中盛有浓KOH溶液,若分别向__________(填“正”或“负”,下同)极通入可燃性气体,向__________极通入O2,则电路中就有电流通过,电流方向由__________极流向__________极,溶液中OH-向__________极移动。试完成下列问题:
?
| 可燃性气体
| 正极反应
| 负极反应
| 电池总反应
| pH变化
| (1)
| H2
| ?
| ?
| ?
| ?
| (2)
| CO
| ?
| ?
| ?
| (3)
| CH4
| ?
| ?
| ?
|
?
4、填空题 人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)蓄电池在放电时起原电池作用,在充电时起电解池的作用。铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
负极反应式为 。
正极反应式为 。
(2)铁、铜、铝是生活中使用广泛的金属,FeCl3溶液常用于腐蚀印刷电路铜板,其反应过程的离子方程式为 ,若将此反应设计成原电池,则负极所用电极材料为 ,正极反应式为 。
(3)将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,负极分别为 。
A.铝片、铜片
B.铜片、铝片
C.铝片、铝片
D.铜片、铜片
|
写出插入烧碱溶液中形成原电池的负极反应式:
。
(4)燃料电池是一种高效、环境友好的供电装置,如图是甲烷燃料电池原理示意图,回答下列问题:
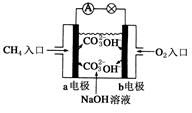
①电池的负极是__________(填“a”或“b”),该极的电极反应式是:________________。
②电池工作一段时间后电解质溶液的pH_________(填“增大”、“减小”或“不变”)。
5、选择题 某小组利用下列装置进行电化学实验,下列实验操作及预期现象正确的是(?)
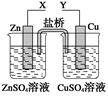
A.X和Y与电流表连接,电子由Cu极流向Zn极
B.X和Y与电流表连接,将Zn换成Fe测得电流更大
C.X和Y分别与电源“-”、“+”极相连,Cu极质量减轻
D.X和Y分别与电源“-”、“+”极相连,Zn极质量减轻
 H2(g)+ CO2(g)?△H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,试回答下列问题:
H2(g)+ CO2(g)?△H<0,某温度下该反应的平衡常数K=1。若起始时c(CO)=1mol?L-1,c(H2O)=2mol?L-1,试回答下列问题:

