|
|
|
ёЯҝј»ҜС§ЦӘК¶өгЧЬҪбЎ¶ФӯөзіШФӯАнЎ·КФМв№®№МЈЁ2019ДкЧоРВ°жЈ©(ЛД)
2019-06-25 21:38:03
Ўҫ ҙу ЦР РЎЎҝ
|
1ЎўСЎФсМв РВРНNaBH4/H2O2ИјБПөзіШЈЁDBFCЈ©өДҪб№№ИзНјЈ¬УР№ШёГөзіШөДЛө·ЁХэИ·КЗ
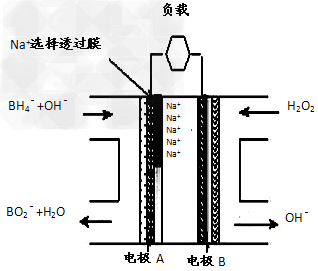
[? ]
AЈ®өзЧУҙУBөзј«ҫӯНвөзВ·БчПтAөзј«
BЈ®өзіШёәј«ЗшөДөзј«·ҙУҰОӘЈә BH?+8OH-ЁD8eЈӯ=BO?+6H2O
CЈ®·Еөз№эіМЦРЈ¬Na+ҙУХэј«ЗшПтёәј«ЗшЗЁТЖ
DЈ®ФЪөзіШ·ҙУҰЦРЈ¬ГҝПыәД1L?6?mol/LH2O2ИЬТәЈ¬АнВЫЙПБч№эөзВ·ЦРөДөзЧУОӘ6NAёц
ІОҝјҙр°ёЈәB
ұҫМвҪвОцЈә
ұҫМвДС¶ИЈәТ»°г
2ЎўМоҝХМв јЧҙјАҙФҙ·бё»ЎўјЫёсөНБ®ЎўФЛКдЦьҙж·ҪұгЈ¬КЗТ»ЦЦЦШТӘөД»Ҝ№ӨФӯБПЈ¬УРЧЕЦШТӘөДУГНҫәНУҰУГЗ°ҫ°ЎЈ
ЈЁ1Ј©№ӨТөЙъІъјЧҙјөДіЈУГ·Ҫ·ЁКЗЈәCO(g)+2H2(g)  ?CH3OH(g)? ЎчH = ЎӘ90.8kJ/molЎЈ ?CH3OH(g)? ЎчH = ЎӘ90.8kJ/molЎЈ
ТСЦӘЈә2H2(g)+O2(g)=2H2O(l)? ЎчH = ЎӘ571.6kJ/molЈ»
H2(g)+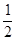 O2(g)=H2O(g)? ЎчH = ЎӘ241.8kJ/molЈ» O2(g)=H2O(g)? ЎчH = ЎӘ241.8kJ/molЈ»
2CO(g)+O2(g)=2CO2(g)? ЎчH = ЎӘ566.0kJ/mol
CH3OH(g) = CH3OH(l)? ЎчH = ЎӘ37.3kJ/mol
ўЩјЖЛгТәМеCH3OHөДИјЙХИИОӘ???ЎЈ
ўЪИфФЪәгОВәгИЭөДИЭЖчДЪҪшРР·ҙУҰCO(g)+2H2(g)  ?CH3OH(g)Ј¬ПВБРұнКҫёГ·ҙУҰҙпөҪЖҪәвЧҙМ¬өДұкЦҫУР???ЈЁМоЧЦДёРтәЕЈ©ЎЈ ?CH3OH(g)Ј¬ПВБРұнКҫёГ·ҙУҰҙпөҪЖҪәвЧҙМ¬өДұкЦҫУР???ЈЁМоЧЦДёРтәЕЈ©ЎЈ
AЈ®УР1ёцHЎӘHјьЙъіЙөДН¬КұУР 3ёцCЎӘHјьЙъіЙ
BЈ®CO°Щ·Цә¬БҝұЈіЦІ»ұд
CЈ®ИЭЖчЦР»мәПЖшМеөДС№ЗҝІ»ұд»Ҝ
DЈ®ИЭЖчЦР»мәПЖшМеөДГЬ¶ИІ»ұд»Ҝ
| ЈЁ2Ј©ЦЖјЧҙјЛщРиТӘөДH2Ј¬ҝЙУГПВБР·ҙУҰЦЖИЎЈәH2O(g)+CO(g)  H2(g)+ CO2(g)?ЎчHЈј0Ј¬ДіОВ¶ИПВёГ·ҙУҰөДЖҪәвіЈКэK=1ЎЈИфЖрКјКұc(CO)=1mol?L-1Ј¬c(H2O)=2mol?LЈӯ1Ј¬КФ»ШҙрПВБРОКМвЈә H2(g)+ CO2(g)?ЎчHЈј0Ј¬ДіОВ¶ИПВёГ·ҙУҰөДЖҪәвіЈКэK=1ЎЈИфЖрКјКұc(CO)=1mol?L-1Ј¬c(H2O)=2mol?LЈӯ1Ј¬КФ»ШҙрПВБРОКМвЈә
ўЩёГОВ¶ИПВЈ¬·ҙУҰҪшРРТ»ҪЧ¶ОКұјдәуЈ¬ІвөГH2өДЕЁ¶ИОӘ0.5mol?L-1Ј¬ФтҙЛКұёГ·ҙУҰv(Хэ)?v(Дж)ЈЁМоЎ°ЈҫЎұЎўЎ°ЈјЎұ»тЎ°ЈҪЎұЈ©Ј»
ўЪИф·ҙУҰОВ¶ИІ»ұдЈ¬ҙпөҪЖҪәвәуЈ¬H2OөДЧӘ»ҜВКОӘ?ЎЈ
ЈЁ3Ј©ДіКөСйРЎЧйЙијЖБЛИзУТНј7ЛщКҫөДјЧҙјИјБПөзіШЧ°ЦГЎЈ
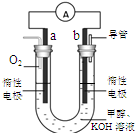
ўЩёГөзіШ№ӨЧчКұЈ¬OHЎӘ Пт??ј«ТЖ¶ҜЈЁМоЎ°aЎұ»тЎ°bЎұЈ©Ј»
ўЪ№ӨЧчТ»¶ОКұјдәуЈ¬ІвөГИЬТәөДpHјхРЎЈ¬ёГөзіШёәј«·ҙУҰөДАлЧУ·ҪіМКҪОӘ?ЎЈ
ІОҝјҙр°ёЈә(12·Ц)
ЈЁ1Ј©726.5KJ/mol(2·Ц)? BC(2·Ц)
(2)> (2·Ц)? 33.3% (2·Ц)
(3)b(2·Ц)? CH3OH + 8OH- - 6e- = CO32- + 6H2O (2·Ц)
ұҫМвҪвОцЈә
(1)ўЩёщҫЭёЗЛ№¶ЁВЙ°С·ҪКҪіМКҪҪшРРјУјхФЛЛгЈ¬өГіцҪб№ыОӘ726.5ЎЈўЪAУҰёГКЗУР2ёцHЎӘHјьЙъіЙөДН¬КұУР 3ёцCЎӘHјьЙъіЙЈ»DЈ®ИЭЖчЦР»мәПЖшМеөДГЬ¶ИКјЦХІ»ұд»ҜЈ¬ОЮ·ЁЧцОӘЕР¶ПТАҫЭЈ»ЈЁ2Ј©ўЩНЁ№эФЛУГИэМ¬·ЁјЖЛгіцҙЛОВ¶ИПВөДЖҪәвіЈКэОӘKЎҜ=0.5*0.5/0.5*1.5=1/3<1,ЛщТФЖҪәвХэПтТЖ¶ҜЈ¬ЛщТФv(Хэ)>v(Дж)ЎЈўЪёщҫЭЖҪәвіЈКэK=1Ј¬ФЛУГИэМ¬·ЁјЖЛгіцH2OөДЧӘ»ҜВКОӘ33.3%ЎЈ
ЈЁ3Ј©ўЩёГөзіШ№ӨЧчКұЈ¬OHЎӘ Птёәј«ТЖ¶ҜЈ¬УЙУЪO2ФЪХэј«ІОјУ·ҙУҰЈ¬ЛщТФbј«УҰёГКЗёәј«ЎЈўЪёәј«ЦРКЧПИЗеіюКЗјЧҙјК§ИҘөзЧУЙъіЙCO2Ј¬ө«УЙУЪөзҪвЦКИЬТәіКјоРФЛщТФІъОпЦРУҰёГУРCO32-ЙъіЙЎЈЛщТФөзј«·ҙУҰКҪОӘCH3OH + 8OH- - 6e- = CO32- + 6H2O (2·Ц)ЎЈ
ұҫМвДС¶ИЈәА§ДС
3ЎўМоҝХМв ДіФӯөзіШЧ°ЦГЦРКўУРЕЁKOHИЬТәЈ¬Иф·ЦұрПт__________(МоЎ°ХэЎұ»тЎ°ёәЎұЈ¬ПВН¬)ј«НЁИлҝЙИјРФЖшМеЈ¬Пт__________ј«НЁИлO2Ј¬ФтөзВ·ЦРҫНУРөзБчНЁ№эЈ¬өзБч·ҪПтУЙ__________ј«БчПт__________ј«Ј¬ИЬТәЦРOHЈӯПт__________ј«ТЖ¶ҜЎЈКФНкіЙПВБРОКМвЈә
?
| ҝЙИјРФЖшМе
| Хэј«·ҙУҰ
| ёәј«·ҙУҰ
| өзіШЧЬ·ҙУҰ
| pHұд»Ҝ
| (1)
| H2
| ?
| ?
| ?
| ?
| (2)
| CO
| ?
| ?
| ?
| (3)
| CH4
| ?
| ?
| ?
|
?
ІОҝјҙр°ёЈәёәЎЎХэЎЎХэЎЎёәЎЎёә
?
Хэј«·ҙУҰ
ёәј«·ҙУҰ
өзіШЧЬ·ҙУҰ
pHұд»Ҝ
(1)
O2Ј«4eЈӯЈ«2H2O
=4OHЈӯ
H2Јӯ2eЈӯЈ«2OHЈӯ=2H2O
2H2Ј«O2=2H2O
ұдРЎ
(2)
COЈӯ2eЈӯЈ«4OHЈӯ= CO32ЎӘЈ«2H2O
2COЈ«O2Ј«4OHЈӯ=2CO32ЎӘЈ«2H2O
ұдРЎ
(3)
CH4Јӯ8eЈӯЈ«10OHЈӯ= CO32ЎӘЈ«7H2O
CH4Ј«2O2Ј«2OHЈӯ= CO32ЎӘЈ«3H2O
ұдРЎ
ұҫМвҪвОцЈәұҫМвЙијЖөДКЗИјБПөзіШЈ¬ҝЙИјРФЖшМеФЪёәј«·ўЙъСх»Ҝ·ҙУҰЈ¬O2ФЪХэј«·ўЙъ»№Фӯ·ҙУҰЈ¬өзЧУҙУёәј«БчіцЈ¬НЁ№эөјПЯБчПтХэј«Ј¬өзЧУБч¶Ҝ·ҪПтәНөзБч·ҪПтХэәГПа·ҙЈ¬ФЪөзіШДЪІҝ(өзҪвЦКИЬТәЦР)ТхАлЧУ(OHЈӯ)Птёәј«ТЖ¶ҜЎЈУЙУЪМвЦРёшіцөДИјБПөзіШКЗјоРФҪйЦКЈ¬ТтҙЛФЪКйРҙөзј«·ҙУҰКҪКұТӘЧўТвөҪH2өДСх»ҜІъОпHЈ«ТФј°COәНCH4өДСх»ҜІъОпCO2УлOHЈӯјМРш·ҙУҰЎЈ
ұҫМвДС¶ИЈәТ»°г
4ЎўМоҝХМв ИЛГЗУҰУГФӯөзіШФӯАнЦЖЧчБЛ¶аЦЦөзіШЈ¬ТФВъЧгІ»Н¬өДРиТӘЎЈТФПВГҝРЎМвЦРөДөзіШ№г·әК№УГУЪИХіЈЙъ»оЎўЙъІъәНҝЖС§јјКхөИ·ҪГжЈ¬ЗлёщҫЭМвЦРМṩөДРЕПўЈ¬МоРҙҝХёсЎЈ
ЈЁ1Ј©РоөзіШФЪ·ЕөзКұЖрФӯөзіШЧчУГЈ¬ФЪідөзКұЖрөзҪвіШөДЧчУГЎЈЗҰРоөзіШФЪ·ЕөзКұ·ўЙъөДөзіШ·ҙУҰКҪОӘЈәPb+PbO2+2H2SO4ЈҪ2PbSO4+2H2OЎЈ
ёәј«·ҙУҰКҪОӘ ЎЈ
Хэј«·ҙУҰКҪОӘ ЎЈ
ЈЁ2Ј©МъЎўНӯЎўВБКЗЙъ»оЦРК№УГ№г·әөДҪрКфЈ¬FeCl3ИЬТәіЈУГУЪёҜКҙУЎЛўөзВ·Нӯ°еЈ¬Жд·ҙУҰ№эіМөДАлЧУ·ҪіМКҪОӘ Ј¬ИфҪ«ҙЛ·ҙУҰЙијЖіЙФӯөзіШЈ¬Фтёәј«ЛщУГөзј«ІДБПОӘ Ј¬Хэј«·ҙУҰКҪОӘ ЎЈ
ЈЁ3Ј©Ҫ«ВБЖ¬әННӯЖ¬УГөјПЯПаБ¬Ј¬Т»ЧйІеИлЕЁПхЛбЦРЈ¬Т»ЧйІеИлЙХјоИЬТәЦРЈ¬·ЦұрРОіЙБЛФӯөзіШЈ¬ФЪХвБҪёцФӯөзіШЦРЈ¬ёәј«·ЦұрОӘ ЎЈ
AЈ®ВБЖ¬ЎўНӯЖ¬
BЈ®НӯЖ¬ЎўВБЖ¬
CЈ®ВБЖ¬ЎўВБЖ¬
DЈ®НӯЖ¬ЎўНӯЖ¬
|
РҙіцІеИлЙХјоИЬТәЦРРОіЙФӯөзіШөДёәј«·ҙУҰКҪЈә
ЎЈ
ЈЁ4Ј©ИјБПөзіШКЗТ»ЦЦёЯР§Ўў»·ҫіУСәГөД№©өзЧ°ЦГЈ¬ИзНјКЗјЧНйИјБПөзіШФӯАнКҫТвНјЈ¬»ШҙрПВБРОКМвЈә
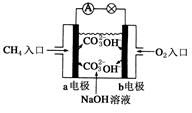
ўЩөзіШөДёәј«КЗ__________ЈЁМоЎ°aЎұ»тЎ°bЎұЈ©Ј¬ёГј«өДөзј«·ҙУҰКҪКЗЈә________________ЎЈ
ўЪөзіШ№ӨЧчТ»¶ОКұјдәуөзҪвЦКИЬТәөДpH_________ЈЁМоЎ°ФцҙуЎұЎўЎ°јхРЎЎұ»тЎ°І»ұдЎұЈ©ЎЈ
ІОҝјҙр°ёЈәЈЁ16·ЦЈ©
ЈЁ1Ј© PbЈ«SO42-
ұҫМвҪвОцЈә
ұҫМвДС¶ИЈәТ»°г
5ЎўСЎФсМв ДіРЎЧйАыУГПВБРЧ°ЦГҪшРРөз»ҜС§КөСйЈ¬ПВБРКөСйІЩЧчј°ФӨЖЪПЦПуХэИ·өДКЗЈЁ?Ј©
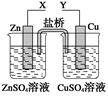
AЈ®XәНYУлөзБчұнБ¬ҪУЈ¬өзЧУУЙCuј«БчПтZnј«
BЈ®XәНYУлөзБчұнБ¬ҪУЈ¬Ҫ«Zn»»іЙFeІвөГөзБчёьҙу
CЈ®XәНY·ЦұрУлөзФҙЎ°ЈӯЎұЎўЎ°Ј«Ўұј«ПаБ¬Ј¬Cuј«ЦКБҝјхЗб
DЈ®XәНY·ЦұрУлөзФҙЎ°ЈӯЎұЎўЎ°Ј«Ўұј«ПаБ¬Ј¬Znј«ЦКБҝјхЗб
ІОҝјҙр°ёЈәC
ұҫМвҪвОцЈәAПоЈ¬ZnЧчёәј«Ј¬өзЧУУЙZnј«БчПтCuј«Ј¬ҙнОуЈ»BПоЈ¬FeЎўCuөД»о¶ҜРФПаІоРЎЈ¬ІвөГөзБчТІРЎЈ¬ҙнОуЈ»CПоЈ¬XОӘZnЎўYОӘCuЈ¬CuЧчСфј«Ј¬Cuұ»өзҪвЈ¬ЦКБҝјхЗбЈ¬CХэИ·Ј¬DҙнОуЎЈ
ұҫМвДС¶ИЈәјтөҘ
 H2(g)+ CO2(g)?ЎчHЈј0Ј¬ДіОВ¶ИПВёГ·ҙУҰөДЖҪәвіЈКэK=1ЎЈИфЖрКјКұc(CO)=1mol?L-1Ј¬c(H2O)=2mol?LЈӯ1Ј¬КФ»ШҙрПВБРОКМвЈә
H2(g)+ CO2(g)?ЎчHЈј0Ј¬ДіОВ¶ИПВёГ·ҙУҰөДЖҪәвіЈКэK=1ЎЈИфЖрКјКұc(CO)=1mol?L-1Ј¬c(H2O)=2mol?LЈӯ1Ј¬КФ»ШҙрПВБРОКМвЈә

