1、选择题 下列化学用语正确的是( )
A.硝基苯的结构简式是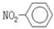
B.乙烯的球棍模型
C.全氟丙烷的电子式F: C : C : C :F
D.CH3-CH=CH2最简式为CH2
参考答案:D
本题解析:A项:因为苯的共价键连接的是氮原子,不是氧原子,故错;B项:图是比例模型,故错;C项:F原子的孤对电子没标出,故错。故选D。
点评:书写结构简式首先得知道该物质的官能团及碳骨架,对各官能团的结构简式要比较明确,不能省碳碳双键及碳碳三键。
本题难度:一般
2、选择题 有一种铁的氧化物,质量为0.4g, 在加热的条件下,用足量的一氧化碳还原,把生成的二氧化碳通入足量澄清的石灰水,得到0.75g沉淀.则这种铁的氧化物的化学式为
A.FeO
B. Fe3O4
C. Fe2O3
D.Fe4O5
参考答案:C
本题解析:根据碳元素守恒,利用碳酸钙的沉淀的质量计算出一氧化碳的物质的量,根据关系式CO+O=CO2可得氧化物中氧的物质的量,从而算出铁的量。
点评:本题的关键在于利用元素守恒定理,可以简化计算。
本题难度:简单
3、填空题 以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度, 若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如图所示。请回答下列问题
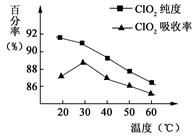
(1)据图可知,反应时需要控制的适宜温度是 ℃,达到此要求采取的适宜措施是 。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式: & #160; 。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得400 mL ClO2溶液,取出20 mL,加入37.00 mL 0.500mol· (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol· K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
4H++ClO2+5Fe2+=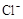 +5Fe3+ +2H2O 14H+ +
+5Fe3+ +2H2O 14H+ +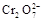 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
试计算ClO2的“产率”。(写出计算过程)
参考答案:(1)30℃,水浴加热(或水浴控制恒温);(2)15ClO3-+FeS2+14H+=15ClO2+Fe3++7H2O+2SO42-
(3)与K2Cr2O7反应的n(Fe2+)=6n(Cr2O72-)=6×20×10-3L×0.0500mol/L=6×10-3mol;
与ClO2反应的n(Fe2+)=37×10-3L×0.0500mol/L-6×10-3mol=1.25×10-2mol
n(ClO2)=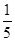 ×1.25×10-2mol=2.5×10-3mol
×1.25×10-2mol=2.5×10-3mol
ClO2的产率=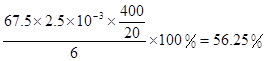
本题解析:(1)据图可知,在20℃反应时ClO2气体制取纯度高,但是气体的吸收率较低,在30℃无论是反应制取ClO2气体纯度高还是气体的吸收率都较高。若温度再升高,制取ClO2气体纯度高还是气体的吸收率都降低。所以需要控制的适宜温度是30℃。达到此要求采取的适宜措施是水浴加热(或水浴控制恒温)。(3)由方程式4H++ClO2+5Fe2+=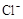 +5Fe3+ +2H2O 14H+ +
+5Fe3+ +2H2O 14H+ +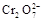 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O可结合电子得失守恒可得1×n(Fe2+)=5×n(ClO2)+2×3×n(Cr2O72-).与K2Cr2O7反应的n(Fe2+)=6n(Cr2O72-)=6×20×10-3L×0.0500mol/L=6×10-3mol;与ClO2反应的n(Fe2+)=37×10-3L× 0.0500mol/L -6×10-3mol=1.25×10-2mol。所以n(ClO2)=
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O可结合电子得失守恒可得1×n(Fe2+)=5×n(ClO2)+2×3×n(Cr2O72-).与K2Cr2O7反应的n(Fe2+)=6n(Cr2O72-)=6×20×10-3L×0.0500mol/L=6×10-3mol;与ClO2反应的n(Fe2+)=37×10-3L× 0.0500mol/L -6×10-3mol=1.25×10-2mol。所以n(ClO2)=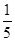 ×1.25×10-2mol=2.5×10-3mol。ClO2的“产率”=
×1.25×10-2mol=2.5×10-3mol。ClO2的“产率”=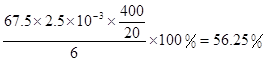 。
。
考点:考查反应条件的选择及采取的方法、氧化还原反应中的电子守恒、物质的产率的计算的知识。
本题难度:困难
4、选择题 下列说法正确的是
A.MnO2+4HCl MnCl2 +Cl2 + 2H2O中,氧化剂和还原剂物质的量之比为1:4
MnCl2 +Cl2 + 2H2O中,氧化剂和还原剂物质的量之比为1:4
B.2H2S+ SO2 =3S+2H2O中,氧化产物和还原产物物质的量之比为1:1
C.3S+ 6KOH =2K2S+ K2SO3+3H2O中,被氧化和被还原的硫元素物质的量之比为2:1
D.5NH4NO3=4N2+2HNO3+9H2O中,反应中发生氧化反应和发生还原反应的氮元素物质的量之比为5:3
参考答案:D
本题解析:略
本题难度:一般
5、选择题 下列物质不能做氧化剂的是
A.KMnO4
B.Fe
C.CuO
D.Cl2
参考答案:B
本题解析:略
本题难度:简单