| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《弱电解质电离平衡》高频考点特训(2019年练习版)(四)
 参考答案:A 本题解析: 本题难度:简单 4、选择题 下列事实说明HNO2为弱电解质的是 |
参考答案:D
本题解析:①若亚硝酸为强酸,则0.1mol/L的亚硝酸溶液的pH=1,而实际为2.1,所以可以说明亚硝酸为弱酸,正确;②若亚硝酸为强酸,则亚硝酸钠溶液在常温下的pH=7,溶液为中性,而实际pH>7,溶液呈碱性,说明亚硝酸是弱酸,正确;③溶液的导电能力与溶液中的离子浓度有关,与电解质的强弱无关,错误;④亚硝酸与KCl不反应,不能说明亚硝酸是弱酸,若为强酸,也不与KCl反应,错误;⑤HNO2能与碳酸钠反应制CO2,说明亚硝酸比碳酸的酸性强,但不能说明亚硝酸是弱酸,错误;⑥酸的强弱与其稳定性无关,错误,所以答案选D。
考点:考查弱电解质的判断
本题难度:一般
5、选择题 下列图示与对应的叙述相符的是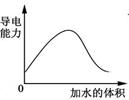


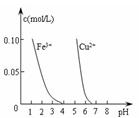
图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
A.图Ⅰ表示t℃时冰醋酸在稀释过程中溶液导电性的变化
B.图Ⅱ表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图Ⅲ表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的大
3C(g)+D(s)的影响,乙的压强比甲的大
D.据图Ⅳ,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右
参考答案:D
本题解析:A中,冰醋酸的导电性应该为0,所以A错误;B中,表示的应该为放热反应分别在有、无催化剂的情况下反应过程中的能量变化,不是吸热,所以B错误;C中错在乙的压强比甲的大,因为对可逆反应2A(g)+2B(g) 3C(g)+D(s),压强越大,反应物的百分比就越小,但是最终的百分比并不相等,故C错误;D项则是正确选项
3C(g)+D(s),压强越大,反应物的百分比就越小,但是最终的百分比并不相等,故C错误;D项则是正确选项
考点:化学平衡,电解质的导电,离子水解
点评:该题具有一定的综合性,并且还结合了图像,是高考考查的重点,具有一定的难度。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《原子核外电.. | |