1、简答题 (1)某温度下,在一密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如下图所示.分析有关数据,写出X、Y、Z反应的化学方程式______.
(2)下列情况可以证明(1)中的反应已达到平衡状态的是______(填序号).
A.物质的浓度:c(X)=c(Y)=c(Z)
B.温度和体积一定时,某一生成物浓度不再变化
C.温度和体积一定时,容器内的压强不再变化
D.温度和体积一定时,混合气体的平均相对分子质量不再变化
(3)某温度下,在另一密闭容器中充入2molX和3molY,然后按(1)中化学方程式进行反应,当达到平衡时,测得Z的物质的量分数为25%,则平衡时X的转化率为______.
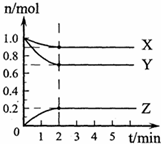
参考答案:(1)由图象可知,X、Y、Z同在2min内物质的量的变化量之比为(1-0.9):(1-0.7):(0.2-0)=1:3:2,
其比值等于化学反应速率之比,也等于化学计量数之比,且由图象可知,2min达到平衡,则该反应为X+3Y?2Z,故答案为:X+3Y?2Z;
(2)化学平衡的特征为“定”、“等”,则
A.物质的浓度:c(X)=c(Y)=c(Z),取决于起始浓度及转化率,不能说明反应达到平衡,故 A不选;
B.温度和体积一定时,某一生成物浓度不再变化,为平衡的“定”特征,则反应达到化学平衡,故B选;
C.温度和体积一定时,容器内的压强不再变化,为平衡的“定”特征,则反应达到化学平衡,故C选;
D.温度和体积一定时,混合气体的平均相对分子质量不再变化,为平衡的“定”特征,则反应达到化学平衡,故D选;
故答案为:BCD;
(3)由(1)可知,反应为X+3Y?2Z,
开始 2 3
转化 x 3x 2x
平衡2-x 3-3x 2x
平衡时,测得Z的物质的量分数为25%,则2x2-x+3-3x+2x×100%=25%,
解得x=0.5mol,则X的转化率为0.5mol2mol×100%=25%,故答案为:25%.
本题解析:
本题难度:一般
2、选择题 对于在一固定容积容器中发生的反应:2SO2(g)+ O2(g)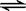 2SO3(g)(正反应为放热反应),下列措施中,既可加快反应速率,又可使平衡向右移动的是?
2SO3(g)(正反应为放热反应),下列措施中,既可加快反应速率,又可使平衡向右移动的是?
A.降温
B.减压
C.加催化剂
D.增加O2
参考答案:D
本题解析:略
本题难度:一般
3、选择题 一定条件下,在N2+3H2 2NH3的化平衡体系中,N2、H2、NH3的浓度分别为
2NH3的化平衡体系中,N2、H2、NH3的浓度分别为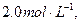
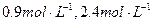 ,若起始时NH3有最大浓度,则起始时N2的浓度为(?)
,若起始时NH3有最大浓度,则起始时N2的浓度为(?)
A.0 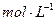
B.3.2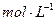
C.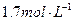
D.无法确定
参考答案:C
本题解析:略
本题难度:简单
4、选择题 下图是反应A2(g)+3B2(g) 2C(g)△H<0
2C(g)△H<0
的平衡移动图,影响该反应平衡移动的原因是?
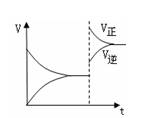 ?
?
A.升高温度
B.增大反应物浓度
C.增大压强
D.使用催化剂
参考答案:C
本题解析:略
本题难度:简单
5、计算题 (9分)在一个容积为500mL的密闭容器中,充入5mol H2和2 mol CO。在一定温度和一定压强下,发生如下反应在:2H2(g) +CO(g) CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的4/7,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K
CH3OH(g),经过5min后达到平衡状态。若此时测得容器内压强是起始时的4/7,求:(1)以H2的浓度变化表示的该反应的速率(2)达平衡时CO的转化率(3)该温度下的平衡常数K
参考答案:(1)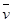 (H2) =1.2mol/(L·min)?
(H2) =1.2mol/(L·min)?
(2)α(CO)=C反应(CO)/ C起始(CO)×100%=75%
(3)K= C(CH3OH )/ C(CO)·C2(H2)="0.1875" (mol/(L)-2
本题解析:2H2(g) +CO(g) CH3OH(g)
CH3OH(g)
n0? 5? 2? 0
△n? 2x? x? x
n(平衡)? 5-2x? 2-x? x
利用PV=nRT,在恒温、恒容下,则n0/ n(平衡)=P0/P(平衡),
(5+2)/[(5-2x)+(2-x)+x]= P0/[4/7 P0],得:x=1.5 mol
(1)υ(H2)=(2x/0.5L)/5min=1.2 mol/(L·min)
(2)CO的转化率=x/2=75%
K=3/(42×1)=0.1875(mol/(L)-2
本题难度:一般