1、选择题 下列图示与对应的叙述相符的是(? )。
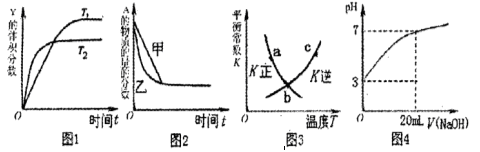
A.图1表示可逆反应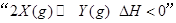 温度
温度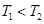 的情形
的情形
B.图2表示压强对可逆反应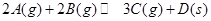 的影响,乙的压强比甲的压强大
的影响,乙的压强比甲的压强大
C.图3中a、b、c三点中只有b点已经达到化学平衡状态
D.图4是向20mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液过程中pH变化曲线
参考答案:A
本题解析:A.由图可知,温度T2先到达平衡,故温度T1<T2,可逆反应2X(g) Y(g)△H<0,正反应为放热反应,升高温度平衡向逆反应移动,Y的含量降低,图象与实际相符合,A正确;B.增大压强反应速率加快,平衡向正反应移动,平衡时A的物质的量降低,图象中到达平衡时间相同,且平衡时A的物质的量相同,图象与实际不符合,B错误;C.图象为正、逆平衡常数与温度关系,曲线上各点都是平衡点,C错误;D.20mL pH=3的醋酸溶液中滴加20mLpH=11的NaOH溶液,由于HAc是弱电解质,反应后为HAc、NaAc混合溶液,HAc浓度远大于NaAc,溶液呈酸性,图象中为中性,图象与实际不符,D错误;选A.
Y(g)△H<0,正反应为放热反应,升高温度平衡向逆反应移动,Y的含量降低,图象与实际相符合,A正确;B.增大压强反应速率加快,平衡向正反应移动,平衡时A的物质的量降低,图象中到达平衡时间相同,且平衡时A的物质的量相同,图象与实际不符合,B错误;C.图象为正、逆平衡常数与温度关系,曲线上各点都是平衡点,C错误;D.20mL pH=3的醋酸溶液中滴加20mLpH=11的NaOH溶液,由于HAc是弱电解质,反应后为HAc、NaAc混合溶液,HAc浓度远大于NaAc,溶液呈酸性,图象中为中性,图象与实际不符,D错误;选A.
本题难度:一般
2、计算题 反应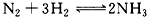 发生在2L的密闭容器中,5 min内NH3的质量增加了1.7 g 求
发生在2L的密闭容器中,5 min内NH3的质量增加了1.7 g 求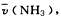
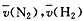 。
。
参考答案: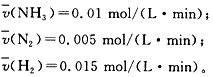
本题解析:
本题难度:一般
3、选择题 如图是恒温下某化学反应的反应速率随反应时间变化的示意图,下列叙述与示意图不相符合的是(? )
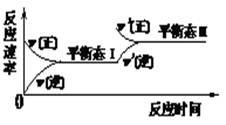
A.反应达平衡时,正反应速率和逆反应速率相等
B.同一种反应物在平衡态I和平衡态II时浓度不相等
C.该反应达到平衡态I后,减小反应物浓度,平衡发生移动,达到平衡态II
D.该反应达到平衡态I后,增大反应物浓度,平衡发生移动,达到平衡态II
参考答案:C
本题解析:根据图像可知,反应达到平衡态I后,改变条件后逆反应速率是不变的,而正反应速率是增大的,所以改变的条件不可能是减小反应物浓度,而应该是增大反应物浓度,即选项C不正确,其余选项都是正确的,答案选C。
点评:在分析有关图像时应该注意:一、ν-t 图像或 c-t 图像 1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。?二、平衡图像 1.出现拐点的图像:分析依据“先拐先平” 。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂)。
本题难度:简单
4、填空题 钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应制取。该反应为:
Na(l)+KCl(l) NaCl(l)+K(g)-Q
NaCl(l)+K(g)-Q
各物质的沸点与压强的关系如下表。
压强/kPa
| 13.33
| 53.32
| 101.3
|
K的沸点/℃
| 590
| 710
| 770
|
Na的沸点/℃
| 700
| 830
| 890
|
KCl的沸点/℃
| ?
| ?
| 1 437
|
NaCl的沸点/℃
| ?
| ?
| 1 465
|
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为__________,而反应的最高温度应低于__________。
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是______________。
参考答案:(1)770 ℃? 890 ℃
(2)降低压强或移去钾蒸气?适当升高温度
本题解析:(1)该反应过程应把温度控制在只有K为气态,则温度范围应高于770 ℃,低于8
90 ℃(不能使钠成为气体)。
(2)只有使平衡正向移动才可提高原料的利用率,可采取的措施有:①减少生成物浓度,即移去钾蒸气;②降
低压强;③适当升高温度。
本题难度:简单
5、填空题 (11分)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链,大大地提高了资源利用率,减少了环境污染。其流程如下:

请回答下列问题:
(1)由CO和H2合成甲醇的化学方程式是CO(g)+2H2(g) CH3O(H(g)。若在恒容密?闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是?
CH3O(H(g)。若在恒容密?闭容器中充入一定量的CO和H2,在一定条件下反应,能说明该反应已达到平衡状态的是?
?(填字母)。
a.容器内压强保持不变? b.容器内气体密度保持不变
c.c(CO)=c(CH3OH)? d.V正(CO)=v逆(CH3OH)
(2)写出流程中氯化时发生反应的化学方程式:?。
(3)20℃时,电解饱和食盐水制得烧碱的混合液中,随着NaOH含量的变化,NaCl达到饱和状态时其溶质质量分数的变化曲线如图所示。现有20℃时,满足曲线上B点所示的溶液,要降低溶液中NaCl的含量,可采用的方法是?。若向B点所示溶液中通入Cl2至恰好呈中性,此时溶液中各离子浓度从大到小的顺序为?。

(4)在某次联合生产过程中,氯碱厂电解电路中通过了20mol电子,同时甲醇厂获得了147.2g甲醇,则理论上冶钛厂可得钛?g(精确到0.1,下同),甲醇厂CO的转化率为?。
参考答案:

本题解析:略
本题难度:一般