1、选择题 等质量的铁、锌、铝与足量的稀盐酸反应,生成氢气由多到少的顺序为
A.铁、锌、铝
B.锌、铁、铝
C.铝、铁、锌
D.铝、锌、铁
参考答案:C
本题解析:当等质量的金属与足量酸反应时,金属的相对原子质量与其化合价的比值越小生成的氢气越多。比值分别为:Fe:56/2=28,Zn: 65/2=32.5, Al:27/3=9 。大小关系一目了然,故正确答案为C。
本题难度:困难
2、选择题 氯气跟下列物质反应时,能够产生白雾的是
A.Na
B.Cu
C.H2
D.Fe
参考答案:C
本题解析:分析:在化学反应中生成固体颗粒为烟,生成气态氢化物结合水蒸气成为小液滴而出现雾,则能够产生白雾说明氯气与物质反应生成气体氢化物.
解答:A、Na为氯气反应生成固体氯化钠,会观察到白烟,故A不选;
B、Cu与氯气反应生成固体氯化铜,会观察到棕黄色的烟,故B不选;
C、H2与氯气反应生成气体HCl,极易结合水蒸气变为盐酸小液滴,则会观察到白雾,故C选;
D、Fe与与氯气反应生成固体氯化铁,会观察到棕褐色的烟,故D不选;
故选C.
点评:本题考查氯气的化学性质,明确化学中的烟雾代表的意义,并熟悉化学反应中的生成物来解答即可,难度不大.
本题难度:一般
3、选择题 一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20.0%,与反应前的体积相比,反应后体积缩小的百分率是
A.16.7%
B.20.0%
C.80.0%
D.83.3%
参考答案:A
本题解析:分析:根据合成氨的化学反应可知氨气的体积等于反应中缩小的气体体积,然后再利用气体缩小的体积与原气体体积来计算反应后体积缩小的百分率.
解答:由合成氨的化学反应达到平衡时,测得混合气体中氨气的体积分数为20.0%,
设平衡时气体总体积为100L,则氨气为100L×20%=20L,
气体缩小的体积为x,则
N2+3H2?2NH3△V
1? 3? 2? 2
? 20L? x
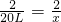 ,解得x=20L,
,解得x=20L,
原混合气体的体积为100L+20L=120L,
反应后体积缩小的百分率为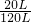 ×100%=16.7%,
×100%=16.7%,
故选:A.
点评:本题考查缺省数据的计算,学生应学会假设有关的计算数据及利用气体体积差来进行化学反应方程式的计算即可解答.
本题难度:一般
4、选择题 下列物质中,既能跟盐酸反应又能跟氢氧化钠溶液反应的是
A.Al(OH)3
B.NaAlO2
C.AlCl3
D.Fe
参考答案:A
本题解析:分析:根据物质间的反应进行判断,中学常见的既能与酸反应又能与碱反应的物质主要有:
①两性物质:Al2O3、ZnO、Al(OH)3、Zn(OH)2、氨基酸、蛋白质等;
②多元弱酸的酸式盐:NaHCO3、KHS、KHSO3、NaH2PO4等;
③弱酸的铵盐及其酸式盐:(NH4)2S、NH4HS、(NH4)2CO3、NH4HCO 3、CH3COONH4等;
④某些具有两性的金属:Zn、Al等;
⑤某些非金属:Si、S等;
⑥其它一些物质.如:a、某些盐类物质既与酸反应,又与碱反应;
b、个别酸性氧化物SiO2;
c、具有还原性的无氧酸:H2S、HI等与氧化性酸反应、与碱反应;
d、具有氧化性酸:浓H2SO4、HNO3等与还原性酸反应、与碱反应,以此解答本题.
解答:A.氢氧化铝是两性氢氧化物,能与盐酸反应生成氯化铝与水,与氢氧化钠反应生成偏铝酸钠与水,故A符合;
B.NaAlO2与盐酸反应生成氯化铝,与氢氧化钠不反应,故B不符合;
C.AlCl3能与氢氧化钠溶液反应生成氢氧化铝或偏铝酸钠,不与盐酸反应,故C不符合;
D.Fe只能与盐酸反应生成氯化亚铁与氢气,不能与氢氧化钠溶液反应,故D不符合;
故选A.
点评:本题考查了物质的性质,难度不大,旨在考查学生对知识的理解识记与知识归纳,明确物质的性质是解本题的关键,注意基础知识的积累.
本题难度:一般
5、选择题 某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路.课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取20mL废液加入足量的AgNO3溶液,生成沉淀?17.22g.(2)另取20mL废液放入铜片充分反应,铜片质量减少了0.32g.下列关于原废液组成的判断错误的是
A.一定含有Fe2+、Fe3+、Cu2+、Cl-
B.c(Fe2+):c(Fe3+)=5:2
C.c(Fe2+):c(Cu2+)=2:1
D.c(Cl-)=6.0?mol?L-1,c(Fe2+)=1.5mol?L-1
参考答案:B
本题解析:分析:废液加入足量的AgNO3溶液,生成沉淀17.22g,沉淀为AgCl,根据n= 计算AgCl的物质的量,根据氯元素守恒计算溶液中n(Clˉ),再根据c=
计算AgCl的物质的量,根据氯元素守恒计算溶液中n(Clˉ),再根据c= 计算原废液中c(Clˉ);
计算原废液中c(Clˉ);
废液放入铜片充分反应,铜片质量减少了0.32g,说明溶液中含有Fe3+,根据铜片减少的质量结合方程式计算溶液中Fe3+的物质的量,进而计算原废液中c(Fe?3+);
由方程式2FeCl3+Cu═2FeCl2+CuCl2可知,原废液中c(Fe2+)=2c(Cu2+),根据电荷守恒,原废液中3c(Fe?3+)+2c(Fe2+)+2c(Cu2+)=c(Clˉ),据此计算原废液中c(Fe2+)、c(Cu2+).
解答:A、废液放入铜片充分反应,铜片质量减少了0.3g,说明溶液中含有Fe3+,结合反应2FeCl3+Cu═2FeCl2+CuCl2可知,原废液一定含有Fe2+、Fe3+、Cu2+、Clˉ,故A正确;
B、废液加入足量的AgNO3溶液,生成沉淀?17.22g,沉淀为AgCl,故n(AgCl)= =0.12mol,原废液中c(Clˉ)=
=0.12mol,原废液中c(Clˉ)=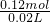 =6mol/L,
=6mol/L,
废液放入铜片充分反应,铜片质量减少了0.32g,物质的量为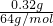 =0.005mol,令20mL废液中Fe3+为nmol,则:
=0.005mol,令20mL废液中Fe3+为nmol,则:
2FeCl3+Cu═2FeCl2+CuCl2
2? 1
nmol?0.005mol
故n=0.010mol,所以原废液中c(Fe?3+)= =0.5mol/L,
=0.5mol/L,
由方程式2FeCl3+Cu═2FeCl2+CuCl2可知,原废液中c(Fe2+)=2c(Cu2+),根据电荷守恒,原废液中3c(Fe?3+)+2c(Fe2+)+2c(Cu2+)=c(Clˉ),原废液中c(Clˉ)=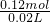 =6mol/L,故3×0.5+2c(Fe2+)+c(Fe2+)=6,解得c(Fe2+)=1.5mol/L,故原废液中c(Fe2+):c(Fe?3+)=1.5mol/L:0.5mol/L=3:1,故B错误;
=6mol/L,故3×0.5+2c(Fe2+)+c(Fe2+)=6,解得c(Fe2+)=1.5mol/L,故原废液中c(Fe2+):c(Fe?3+)=1.5mol/L:0.5mol/L=3:1,故B错误;
C、由方程式2FeCl3+Cu═2FeCl2+CuCl2可知,原废液中c(Fe2+)=2c(Cu2+),故C正确;
D、由B中分析可知,c(Clˉ)=6mol/L,c(Fe2+)=1.5mol/L,故D正确;
故选B.
点评:本题考查根据方程式的计算、混合溶液的有关计算等,难度中等,注意电荷守恒的运用.
本题难度:简单