1、选择题 U(铀)是重要的核工业原料,常见化合价有+4和+6。硝酸铀酰[UO2(NO3)2]加热可发生如下分解:?UO2(NO3)2→UXOY+NO2↑+O2↑。在600K时,收集满一试管气体产物,并将试管倒扣于水中,气体全部被吸收,水充满试管。则生成铀的氧化物中铀元素的化合价是
A.+4
B.+6
C.+4和+6
D.0
参考答案:B
本题解析:由4NO2 +O2 +2H2O = 4HNO3可知,气体全部被吸收,NO2和O2体积比为4:1,根据2UO2(NO3)2→UXOY+4NO2↑+O2↑推知x=2,y=6,U为+6价。
本题难度:简单
2、选择题 为了验证Na2CO3固体中是否含有NaHCO3,下列实验事实及判断中,正确的是
A.溶于水后加石灰水,看有无沉淀
B.加热后称重,看质量是否变化
C.加稀盐酸观察是否有气体产生
D.在无色火焰上灼烧,观察火焰是否呈黄色
参考答案:B
本题解析:试题分析:A中碳酸钠和碳酸氢钠均能和石灰水反应生成白色沉淀碳酸钙,不能鉴别;B中碳酸氢钠受热易分解生成碳酸钠、水和CO2,而碳酸钠的热稳定性强,通过质量变化可以鉴别;C中稀盐酸和碳酸钠以及碳酸氢钠均反应放出CO2,不能鉴别;D中二者的焰色反应都是显黄色的,不能鉴别,答案选B。
考点:考查碳酸钠和碳酸氢钠鉴别的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题。重点考查学生的实验分析、设计以及评价能力,有利于培养学生规范严谨的实验设计能力,提升学生的学科素养,有利于激发学生的学习兴趣和学习积极性。
本题难度:简单
3、选择题 55g铁、铝混合物与足量的盐酸反应,生成标准状况下的氢气44.8L,则混合物中铁和铝的物质的量之比为
A.1:1
B.1:2
C.2:1
D.1:3
参考答案:B
本题解析:分析:铁、铝混合物与足量的盐酸反应,方程式分别为:Fe+2HCl=FeCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,根据质量和生成氢气的体积列方程组计算.
解答:n(H2)=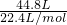 =2mol.
=2mol.
设混合物中含有Fexmol,Alymol,
已知反应:Fe+2HCl=FeCl2+H2↑,2Al+6HCl=2AlCl3+3H2↑,则
Fe+2HCl=FeCl2+H2↑
x? x
2Al+6HCl=2AlCl3+3H2↑
y? 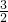 y
y
则有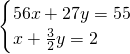
解之得: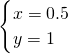 ,
,
所以n(Fe):n(Al)=0.5:1=1:2,
故选B.
点评:本题考查混合物的计算,题目难度不大,本题注意根据反应的化学方程式结合固体的质量和生成氢气的体积列方程组计算即可解答,题目较为基础,但很典型.
本题难度:一般
4、选择题 将O2、CH4、Na2O2放入密闭容器中,在150℃条件下电火花引发恰好完全反应后,容器中的压强为零。原O2、CH4、Na2O2物质的量之比为
A.1∶2∶6
B.2∶1∶6
C.1∶2∶8
D.2∶1∶4
参考答案:A
本题解析:在150℃条件下,则水可看做气体;
恰好完全反应后,容器中的压强为零,说明O2、CH4、Na2O2三者恰好完全反应,且无气体生成;
 CH4+2O2? CO2+2H2O?①
CH4+2O2? CO2+2H2O?①
2Na2O2+2CO2=2Na2CO3+O2?②
2Na2O2+2H2O=4NaOH+O2↑?③
①+②/2+③,得:1/2O2+CH4+3Na2O2=Na2CO3+4NaOH
所以,原O2、CH4、Na2O2物质的量之比为 1∶2∶6
本题难度:困难
5、选择题 甲醛(分子式HCHO)为较高毒性的物质,已经被世界卫生组织确定为致癌和致畸形物质,是公认的变态反应源和强致突变物之一.若将3.0g的甲醛HCHO气体与足量氧气充分燃烧后,立即将全部燃烧产物通入足量的Na2O2固体,充分反应后,固体质量增加
A.3.0g
B.4.2g
C.8.4g
D.无法计算
参考答案:A
本题解析:分析:H2和CO与氧气反应生成二氧化碳和水,二氧化碳和水与过氧化钠反应,都使Na2O2粉末增重,HCHO相当于H2和CO按1:1混合,据此来分析.
解答:因为H2和CO与氧气反应生成二氧化碳和水,二氧化碳和水与过氧化钠反应,都使Na2O2粉末增重,
根据方程式2CO+O2=2CO2;2H2+O2=2H2O;HCHO+O2=CO2+H2O,2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2↑可知,
二氧化碳与过氧化钠反应增重为开始CO的质量,水与过氧化钠反应增重为开始H2的质量,
HCHO(g)与氧气反应生成二氧化碳和水,HCHO相当于H2和CO按1:1混合,其燃烧生成二氧化碳和水,
所以3.0g的甲醛HCHO气体与足量氧气充分燃烧后,立即将全部燃烧产物通入足量的Na2O2固体,使Na2O2粉末增重为HCHO的质量.
故选A.
点评:解题关键清楚:1、若HCHO(g)、H2和CO组成的混合气体完全燃烧,则Na2O2粉末增重为混合气体的质量,若不能完全燃烧则Na2O2粉末增重小于混合气体的质量;
2、根据方程式判断混合物完全燃烧需氧气量.
本题难度:简单