1、选择题 有相同条件下的三个反应:
①2A-+B2 =2B-+A2?②2C-+A2=2A-+C2? ③2B-+D2=2D-+B2
由此得出,下列判断不正确的是 (?)
A.氧化性:A2 >B2>C2 >D2
B.还原性:C->A->B->D-
C.2A-+D2 =2D-+A2该反应可以进行
D.2C-+B2 =2B-+C2该反应也能进行
参考答案:A
本题解析:反应中氧化剂的氧化性大于氧化产物的氧化性,所以,氧化性:D2 >B2>A2 >C2 ?
还原剂的还原性大于还原产物的还原性?还原性:C->A->B->D-
由此可判断C、D都正确
本题难度:简单
2、填空题 (11分)回答下列问题
(1)在2FeBr2+3Cl2=2FeCl3+2Br2的反应中,被氧化的元素是_____________
(2)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成淡绿色溶液(FeCl2);浓盐酸中滴加KMnO4溶液产生黄绿色气体(Cl2)。则Cl2、Fe3+、MnO4-氧化性由强到弱的顺序是____________________。
(3)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式____________________________________________。
(4)在一定条件下,RO3n-和Cl2可发生如下反应:RO3n-+Cl2+2OH-=RO42-+2Cl-+H2O
由以上反应可知在上述过程中RO3n-被________________(填“氧化”或“还原”),RO3n-中元素R的化合价是______________。
参考答案:(11分)(1)Fe(2分)和Br(2分) (2)MnO4->Cl2>Fe3+?(2分)
(3)3CuO+2NH3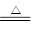 3Cu+N2+3H2O(2分)(4)氧化(1分)? +4(2分)
3Cu+N2+3H2O(2分)(4)氧化(1分)? +4(2分)
本题解析:(1)根据反应的方程式可知,溴化铁中铁元素的化合价从+2价升高到+3价,被氧化。而溴元素的化合价溴-1价升高到0价,被氧化。
(2)在氧化还原反应中氧化剂的氧化性强于氧化产物的,所以反应中的实验现象可判断,Cl2、Fe3+、MnO4-氧化性由强到弱的顺序是MnO4->Cl2>Fe3+。
(3)因为氧化铜具有氧化性,所以根据原子守恒可知,两种单质应该是氮气和铜,则反应的化学方程式是3CuO+2NH3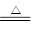 3Cu+N2+3H2O。
3Cu+N2+3H2O。
(4)氯元素的化合价降低,所以氯气是氧化剂,则RO3n-被氧化,作还原剂。RO42-中R元素的化合价是+6价,所以根据电子的得失守恒可知,RO3n-中元素R的化合价是+(6-2)=+4价。
点评:该题是中等难度的试题,试题基础性强,侧重能力的培养。该题的关键是准确标出有关元素的化合价变化情况,然后根据氧化还原反应的有关概念灵活运用、计算判断即可。
本题难度:一般
3、实验题 (10分)利用下图装置采用适当试剂可完成实验某探究实验,并得出相应实验结论,实验所用试剂或所得结论列于表中。请回答:
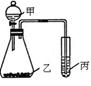
实验试剂
| 实验结论
|
甲
| 乙
| 丙
|
①
| 高锰酸钾
| ②
| 氧化性:KMnO4>Cl2>Br2
|
 (1)图中①为?,②为?。
(1)图中①为?,②为?。
 (2)请你根据上述实验装置再设计一个实验,并将选择的试剂、丙中的现象以及根据实验现象得出的实验结论填入下表;
(2)请你根据上述实验装置再设计一个实验,并将选择的试剂、丙中的现象以及根据实验现象得出的实验结论填入下表;
试剂甲
| 试剂乙
| 试剂丙
| 丙中现象
| 实验结论
|
?
| ?
| ?
| ?
| 酸性:盐酸>碳酸
|
?
| ?
| 石蕊试液
| ?
| ?
|
?
参考答案:(1)① 浓盐酸? ②? NaBr或KBr溶液
(2)
 试剂甲
试剂甲
试剂乙
试剂丙
丙中现象
实验结论
稀盐酸
大理石
澄清石灰水
白色沉淀
酸性:盐酸>碳酸
浓盐酸
高锰酸钾
石蕊试液
先变红,后腿色
氯水既有酸性,又具有漂白性
本题解析:(1)由氧化性强的制取氧化性弱的物质,所以①为浓盐酸,②为NaBr或KBr溶液。
(2)要证明酸性的强弱,用强酸制取弱酸。要证明氯水的漂白性,要先制氯气。所以该表为
 试剂甲
试剂甲
试剂乙
试剂丙
丙中现象
实验结论
稀盐酸
大理石
澄清石灰水
白色沉淀
酸性:盐酸>碳酸
浓盐酸
高锰酸钾
石蕊试液
先变红,后腿色
氯水既有酸性,又具有漂白性
考点:
点评:本题非常基础简单,主要考查学生对元素周期律的理解。
本题难度:一般
4、选择题 下列说法正确的是?
A.S02和Cl2都能使品红溶液褪色,且加热后均恢复原色
B.Si02是酸性氧化物,能与NaOH溶液反应
C.高温时,CuO比Cu2O稳定
D.将铜片放入浓硫酸中,无明显现象,说明铜在冷的浓硫酸中发生钝化
参考答案:B
本题解析:A项,S02和Cl2都能使品红溶液褪色,但加热后后者不能恢复原色;B项,正确;C.高温时,CuO可以分解为Cu2O,所以Cu2O比较稳定;D项,只能说明铜在冷的浓硫酸中不发生反应。
点评:S02和Cl2都具有漂白性,但二者漂白原理不同,S02是和有色物质结合生成无色的物质,加热后这种物质会重新分解为有色物质,而Cl2是与有色物质发生氧化还原反应,使有色物质分解为无色物质;
本题难度:简单
5、选择题 离子反应、复分解反应、置换反应和氧化还原反应之间可用下列集合关系表示,其中正确的是
[? ]
A.
B.
C.
D.
参考答案:A
本题解析:
本题难度:简单