1、选择题 指出下列反应中,水既不是氧化剂又不是还原剂的反应(?)
A.Na与H2O
B.Mg与H2O(沸水)
C.Cl2与H2O
D.Al与NaOH水溶液
参考答案:C
本题解析:选项ABCD都是氧化还原反应,但ABD中水都是氧化剂,C中氯气既是氧化剂又是还原剂,水既不是氧化剂,也不是还原剂。答案选C。
本题难度:简单
2、填空题 (6分)稀硝酸和足量的铁反应的化学方程式如下:
3Fe + 8HNO3 = 3Fe(NO3)2+ 2NO↑+ 4H2O?
(1)该氧化还原反应的氧化剂是?,氧化产物是?。
(2)请用双线桥法表示出电子转移的方向和数目:
3Fe +8HNO3 = 3Fe(NO3)2+2NO↑+4H2O
(3)若生成标准状况下11.2LNO气体,反应中被还原的HNO3的物质的量为________。
参考答案:(共6分)?(1)HNO3;? Fe(NO3)2? (各1分)
(2)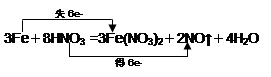 (2分)
(2分)
(3)0.5 mol? (2分)
本题解析:(1)根据反应放热化学方程式可知,铁元素的化合价从0价升高到+2价,失去2个电子;硝酸中氮元素的化合价从+5价降低到+2价,得到3个电子,所以硝酸是氧化剂,硝酸亚铁是氧化产物。
(2)根据电子的得失守恒可知,用双线桥法表示出电子转移的方向和数目为
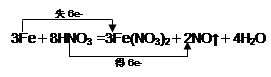
(3)硝酸的还原产物是NO,物质的量是11.2L÷22.4L/mol=0.5mol,所以根据氮原子守恒可知,被还原的硝酸的物质的量是0.5mol。
点评:本题是高考中的常见考点之一,试题难易适中,侧重能力的考查。氧化还原反应判断的关键是准确标出有关元素的化合价变化情况,然后根据有关概念判断即可。而氧化还原反应的计算,则一般利用电子的得失守恒进行。
本题难度:一般
3、填空题 由于NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须经处理后才能排放。处理方法之一的原理如下:
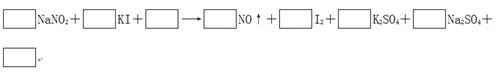 ?
?
(1)请完成并配平该化学方程式。
(2)在上述反应中,若要生成50.8 g I2,则电子转移了________个。
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是
________________________________________________________________________。
从环保角度来讲,要处理NaNO2,所用物质的________(填“还原性”或“氧化性”)应该比KI更______(填“强”或“弱”)。
参考答案:(1)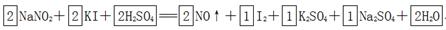
(2)2.408×1023(或0. 4NA)? (3)反应生成了NO,该物质会造成大气污染;还原性;强
本题解析:(1)根据方程式可知,碘化钾中碘元素的化合价从-1价升高到0价,失去1个电子,做还原剂。亚硝酸钠中氮元素的化合价从+3价降低到+2价,得到1个电子,做氧化剂。则根据电子守恒可知氧化剂和和还原剂的物质的量之比时1:1。根据原子守恒可知,反应物中还有硫酸生成,生成物还有水生成,则反应的化学方程式是2NaNO2+2KI+2H2SO4=2NO↑+I2+K2SO4+Na2SO4+2H2O。
(2)50.8g单质碘的物质的量是50.8g÷254g/mol=0.2mol,所以转移电子的物质的量是0.2mol×2=0.4mol,个数是0.4NA。
(3)由于反应生成了NO,该物质会造成大气污染,所以该方法不是最佳方法。从环保角度来讲,要处理NaNO2,所用物质的还原性应该比KI更强。
点评:该题是基础性试题的考查,主要是考查学生对氧化还原反应的判断、配平以及计算的了解掌握情况。该题的关键是准确标出有关元素的化合价变化情况,然后结合题意和电子得失守恒灵活运用即可,难度不大。
本题难度:一般
4、选择题 24 mL 0.05 mol·L-1的 Na2SO3溶液恰好与20 mL 0.02 mol·L-1的K2R2O7的溶液完全反应,则R元素在还原产物中的化合价为
0.02 mol·L-1的K2R2O7的溶液完全反应,则R元素在还原产物中的化合价为
A.0
B.+2
C.+3
D.+6
参考答案:C
本题解析:略
本题难度:简单
5、选择题 在室温下,发生下列几种反应:
①16H++10Z-+2XO4-===2X2++5Z2+8H2O
②2A2++B2===2A3++2B-
③2B-+Z2===B2+2Z-
根据上述反应,判断下列结论错误的是? ( )
A.溶液中可发生:Z2+2A2+===2A3++2Z-
B.Z2在①、③反应中作还原剂
C.氧化性强弱的顺序为:XO4->Z2>B2>A3+
D.X2+是XO4-的还原产物
参考答案:B
本题解析:根据反应②③可知,Z2的氧化性强于A3+的,所以选项A正确;根据氧化剂的氧化性强于氧化产物的可知,选项C正确;同样选项D中XO4-是氧化剂,所以Z2在①中是氧化产物,所以X2+是还原产物;在③中是氧化剂,B不正确,答案选B。
本题难度:简单