1、填空题 (8分)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:
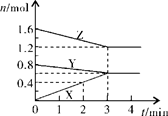
(1)该反应的化学方程式:?;
(2)反应开始至2min末,X的反应速率为??;
(3)平衡时Z的转化率为?。
(4)3min后图中曲线所表示的含义是?。
参考答案:(1)3X Y+2Z?(2)0.1mol/(L·min)
Y+2Z?(2)0.1mol/(L·min)
(3)25%?(4)表示该条件下的化学平衡状态
本题解析:(1)由图像可知Y和Z的物质的量是减少的,X的物质的量是增加的,所以Y和Z是反应物,X是生成物。达到平衡时X、Y、Z的变化量分别是0.6mol、0.2mol、0.4mol,即变化量之比是3︰1︰2,所以反应的方程式是3X Y+2Z。
Y+2Z。
(2)在2min时X的物质的量是0.4mol,所以其反应速率是 。
。
(3)平衡时Z的物质的量是1.2mol,所以其转化率是 。
。
(4)根据图像可知,反应是可逆反应,当反应进行到3min时,各种物质的物质的量不再随时间的变化而变化,说明反应已经达到化学平衡状态。
本题难度:一般
2、选择题 反应mA(g)+nB(g)?pC(g)+qD(g),经5min后达到平衡,测得此时A的浓度减少了a?mol/L,同时C的浓度增加了2a/3mol/L,又测得平均反应速率v(C)=2v(B).达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为
( )
A.2A(g)+6B(g)?3C(g)+5D(g)
B.3A(g)+B(g)?2C(g)+2D(g)
C.3A(g)+B(g)?2C(g)+D(g)
D.A(g)+3B(g)?2C(g)+2D(g)
参考答案:A的浓度减少了a?mol/L,同时C的浓度增加了2a/3mol/L,则m:p=amol/L:2a3mol/L=3:2,
平均反应速率v(C)=2v(B),故v(C):v(B):v(C)=n:p=1:2,故m:n:p=3:1:2,
平衡后,若保持温度不变,给体系加压,平衡不移动,故反应前后气体的物质的量不变,即m+n=p+q,故3+1=2+q,故q=2,所以m:n:p:q=3:1:2:2,
故选B.
本题解析:
本题难度:一般
3、填空题 在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
物?质
| A
| B
| C
|
初始浓度/mol·L-1
| 1.0
| 2.0
| 0
|
2min时,平衡浓度/mol·L-1
| 0.4
| 0.2
| 1.2
|
请填写下列空白:
(1)该反应方程式可表示为?;反应达平衡时,A的转化率为?。
(2)从反应开始到达化学平衡,反应物A的平均反应速率为?;25℃时,反应的化学平衡常数K值为_____________。
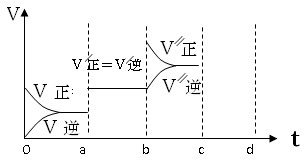
(3)若已知该反应为放热反应,下图表示由于条件改变而引起反应速度和化学平衡的变化情况:a b过程中改变的条件可能是?;b c过程中改变的条件可能是?。
(4)如果上述反应起始是按“1molA+3molB”充入,达平衡时C的浓度为a mol/L;维持容器体积和温度不变,按下列方法改变起始物质的量,达到平衡时C的浓度仍为a mol/L的是?(填序号):
①2 mol A+6 mol B?②2mol C?③4mol C?④0.5 mol A+1.5mol B+1 mol C
参考答案:(每空2分,共14分)
(1)A(g) + 3B(g) 2C(g)?(2分)? 60%(2分)
2C(g)?(2分)? 60%(2分)
(2)0.3 mol/(L﹒min) (2分)? 4.5×102 或450·L2·mol-2(2分)
(3)加入催化剂(2分)?增加A或B(或反应物的浓度,2分)[说明:增大压强和升高温度v(正) 、v(逆)都会瞬间增大,v″(逆)不能与平衡时v′(逆)的相连]
(4)②④?(2分,选1个且正确1分;错1个0分)
本题解析:(1)根据表中数据可知,2min后A的浓度减少0.6mol/L,B的浓度减少1.8mol/L,而C的浓度增加1.2mol/L,所以根据物质的变化量之比是相应的化学计量数之比可知,该反应的方程式是A(g) + 3B(g) 2C(g)。反应达平衡时,A的转化率为0.6÷1.0=0.6,即60%。
2C(g)。反应达平衡时,A的转化率为0.6÷1.0=0.6,即60%。
(2)2min内物质A的浓度变化了0.6mol/L,所以反应物A的平均反应速率为0.6mol/L÷2min=0.3 mol/(L﹒min)。化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的方程式可知,该反应的平衡常数是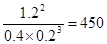 。
。
(3)根据图像可知,a b过程中正逆反应速率都是增大的,但平衡不移动。由于反应是体积减小的可逆反应,所以改变的条件只能是使用了催化剂;b c过程中逆反应速率逐渐增大,而正反应速率突然增大,然后逐渐再降低,平衡向正反应方向移动,所以改变的条件是增加A或B(或反应物)浓度。
(4)由于反应过程中容器容积和温度是不变的,则要使平衡等效,则根据化学方程式换算之后最初的A和B的物质的量必须分别等于1mol和3mol。2molC就相当于是1molA和3molB,题意选项④正也相当于是1molA和3molB,而选项①和③是等效的,因此正确的答案选②④。
本题难度:一般
4、填空题 (9分) 在一定体积的密闭容器中,进行如下可逆化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
回答下列问题:
(1)该反应的化学平衡常数表达式为K=?;
(2)能判断该反应是否达到化学平衡状态的依据是?(多选扣分)。
A.容器中压强不变? B.混合气体中 c(CO)不变
C.V正(H2O)= V逆(H2O)? D.c(CO2)= c(CO)
(3) 800℃时,反应CO(g)+H2O(g) ? CO2(g)+H2(g)的平衡常数K=?。
? CO2(g)+H2(g)的平衡常数K=?。
参考答案:(1)K=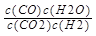 ?(2)B、C?(3)1.1
?(2)B、C?(3)1.1
本题解析:(1)根据化学平衡常数的定义:化学平衡常数指一定温度下,可能反应到达平衡是各生成物浓度幂之积与各反应物浓度幂之积的比值,结合反应CO2(g)+H2(g)?CO(g)+H2O(g)知,该反应的化学平衡常数表达式为K=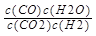 ;(2)A、该反应反应前后气体的物质的量不变,温度一定,容器中压强始终不变,不能说明到达平衡状态,错误;B、反应达到平衡状态时,各物质的浓度不变,混合气体中c(CO)不变,说明到达平衡状态,正确;C、v?(H2)正=v?(H2O)逆不同物质表示的速率之比等于化学计量数之比,说明到达平衡状态,正确;D、c(CO2)=c(CO)不能说明到达平衡,错误;选B、C;(3)CO(g)+H2O(g)
;(2)A、该反应反应前后气体的物质的量不变,温度一定,容器中压强始终不变,不能说明到达平衡状态,错误;B、反应达到平衡状态时,各物质的浓度不变,混合气体中c(CO)不变,说明到达平衡状态,正确;C、v?(H2)正=v?(H2O)逆不同物质表示的速率之比等于化学计量数之比,说明到达平衡状态,正确;D、c(CO2)=c(CO)不能说明到达平衡,错误;选B、C;(3)CO(g)+H2O(g) CO2(g)+H2(g)与题给反应互为逆反应,化学平衡常数K互为倒数,800℃时,平衡常数K=0.9,所以CO(g)+H2O(g)?CO2(g)+H2(g),化学平衡常数为1/0.9=1.1。
CO2(g)+H2(g)与题给反应互为逆反应,化学平衡常数K互为倒数,800℃时,平衡常数K=0.9,所以CO(g)+H2O(g)?CO2(g)+H2(g),化学平衡常数为1/0.9=1.1。
本题难度:一般
5、填空题 (5分)在密闭容器中,当合成氨的反应N2+3H2===2NH3(正反应是放热反应)达到平衡时,改变如下的一些条件:
A.升温,
B.加压,
C.减压,
D.增大c(H2),(E)减小c(NH3),(F)增大c(NH3),若平衡向右移动用“ →”,若平衡向左移动用“←”表示;若值增加用“↑”表示,若值减小用“↓”表示,请根据下表中各项的变化情况,在改变条件栏目中填上相应的编号(每项只改变一个条件)。