1、选择题 向一个容积为5L的密闭容器中通入5 mol A与8 mol B,在一定条件下发生反应 (x,y均为正整数)。反应进行2min后达到平衡,这2min 内平均反应速率v(C) =0.3 mol/(L·min),D的平衡浓度为0.3 mol/L,又知v(B):v(C)=3:2,则下列说法错误的是
(x,y均为正整数)。反应进行2min后达到平衡,这2min 内平均反应速率v(C) =0.3 mol/(L·min),D的平衡浓度为0.3 mol/L,又知v(B):v(C)=3:2,则下列说法错误的是
[? ]
A.x:y=2:1
B.v(A):v(C)=2:1
C.A的平衡浓度为0. 4 mol/L
D.A与D的平衡浓度之比为2:3
参考答案:BD
本题解析:
本题难度:一般
2、选择题 恒温(1100℃)恒容密闭容器中发生反应:Na2SO4(s)+4H2(g)→Na2S(s)+4H2O(g)。下列说法正确的是( )
A.该反应的平衡常数表达式K=c(H2O)/c(H2)
B.若容器内气体的密度或压强保持不变,均说明该反应已达到平衡状态
C.若Na2SO4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变
D.若初始时投入2.84gNa2SO4与一定量H2,反应达平衡时容器内固体共有2.264g,则Na2SO4的转化率为45%
参考答案:CD
本题解析:A错,平衡常数为平衡后生成物浓度幂之积与反应物浓度幂之积的比值;即该反应的平衡常数表达式为K=c4(H2O)/c4(H2),注意在表达式中固体、纯液体不能列入平衡常数表达式中;
B错,若容器内气体的密度保持不变,均说明该反应已达到平衡状态;但压强保持不变不能说明达到平衡状态,因为该反应是等体积反应,每时每刻压强不变;
C正确,该反应为等体积反应,达到等效平衡的条件为投料量成比例即可;
D正确,利用三段法(起始量、变化量、平衡量)及变化量之比=化学计量数之比即可求得。
本题难度:一般
3、选择题 一定温度的恒容密闭容器中进行如下可逆反应A(s) + 2 B(g)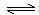 2C(g)。下列叙述中,能说明反应已达到化学平衡状态的是
2C(g)。下列叙述中,能说明反应已达到化学平衡状态的是
A.C消耗的速率与A消耗的速率相等
B.单位时间内生成a mol A,同时生成2a mol C
C.容器内的压强不再变化
D.混合气体的密度不再变化
参考答案:BD
本题解析:略
本题难度:简单
4、填空题 (15分)甲醇(CH3OH)是用来制备汽油添加剂和许多普通塑料的原料,低温液相合成甲醇的方法如下。
反应原理:2H2+ CO→CH3OH;反应条件:以三乙二醇二甲醚作为溶剂,以Raney-Ni和CH3ONa为催化剂。
(1)氢碳比[γ = ]:当γ=2时,甲醇的选择性[λ =
]:当γ=2时,甲醇的选择性[λ =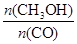 ]达99.8%以上;当γ>2时,可能产生副产物CH4,写出相应反应的化学方程式?。
]达99.8%以上;当γ>2时,可能产生副产物CH4,写出相应反应的化学方程式?。
(2)干燥除水:为防止CH3ONa的水解,必须干燥除水,下表是不同干燥方法时对CO转化率的影响。
序号
| 干燥方法
| CO转化率/%
|
①
| 不处理
| 40.2
|
②
| 无水乙醇洗
| 56.3
|
③
| 以四氢呋喃洗
| 62.4
|
④
| 无水乙醇洗并真空干燥
| 70.1
|
⑤
| ?
| 77.2
|
从实验设计完整性思考,请补充实验⑤中的干燥方法。
(3)反应温度:下图是 = 2时甲醇合成过程中压力和温度随时间变化的图像。
= 2时甲醇合成过程中压力和温度随时间变化的图像。

在反应CO(g)+2H2(g)→CH3OH(g)?△H中,△H?0(填“>”或“<”);0~t2时间段内,随反应的进行体系的压力先增大后减小,原因是?;能判断该反应基本结束的时刻为?;若t3时刻,测得平衡后CO的转化率为75%,若起始反应时的CO的物质的量为a mol,假设反应容器的体积为1L,则t3时的平衡常数的值为?。
(4)催化剂:在保持其它条件不变,只改变催化剂的用量,分别在1L恒容密闭容器中反应,测定10min时的CO转化率。下图是Raney-Ni为0.05g时,CO转化率与时间关系图,请画出Raney-Ni为1g时,CO转化率与时间变化图。
参考答案:(1)3H2+ CO→CH4+H2O (2分)?(2)以四氢呋喃洗并真空干燥 (2分)
(3)< (2分)?反应开始时因温度升高,压力增大;随着反应的进行,气体物质的量减少,压力降低(2分)?t2 (2分)?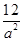 (2分)
(2分)
(4)? ?(3分,若画出的曲线与原来曲线相同,也给分)
?(3分,若画出的曲线与原来曲线相同,也给分)
本题解析:(1)根据质量守恒定律,生成CH4外还应该生成水,故化学方程式为3H2+ CO→CH4+H2O。(2)为使实验具有可比性,以四氢呋喃洗涤时也应该真空干燥。(3)从图像可看出,随着反应的进行,温度升高,说明反应放热,即△H<0;反应为放热反应,开始时温度升高,则压强增大;随着反应的进行,气体减少,则压强降低;t2时,温度和压强都不再发生变化,说明反应已基本结束;CO的起始浓度为amol/L,平衡浓度为(1-75%)amol/L,H2的平衡浓度为2×(1-75%)amol/L,CH4OH的平衡浓度为0.75amol/L,故平衡常数为K =  =
= 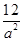 ?L-2·mol-2。(4)题目本意是增加催化剂的量,反应速率加快,即到达平衡的时间缩短,但不改变平衡状态。
?L-2·mol-2。(4)题目本意是增加催化剂的量,反应速率加快,即到达平衡的时间缩短,但不改变平衡状态。
本题难度:一般
5、简答题 I、恒温下,将amolN2与bmolH2的混合气体通入一个固体容积的密闭容器中,发生如下反应:N2(g)+3H2(g)?2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a=______.
(2)反应达到平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%.计算平衡时NH3的物质的量______.
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)=______.
(4)原混合气体中,a:b=______.
(5)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)=______.
(6)平衡混合气体中,n(N2):n(H2):n(NH3)=______.
II、若向体积不变的密闭容器中充入2molN2和6molH2,一定条件下发生反应:
N2(g)+3H2(g)?2NH3(g),平衡时混合气共7mol.令a、b、c分别代表N2、H2、NH3起始加入的物质的量,维持温度不变,使达到平衡时各成分的百分含量不变.则:
(1)若a=0,b=0,则c=______.
(2)若a=0.7,b=2.1,则:
①c=______.
②这时反应向______进行,因为:______.
③若要维持反应开始向该反应方向进行,c的范围是______.
(3)欲使起始反应维持向与②相反的方向进行,则b的范围是______.
参考答案:(1)由反应的化学方程式得知,反应掉的N2和生成NH3的物质的量之比为1:2,设转化的N2的物质的量为xmol,
则x:6=1:2,解之x=3,所以a=13+3=16mol,故答案为:16;
(2)由n=716.8L22.4L/mol=32mol,NH3的含量(体积分数)为25%,
n平(NH3)=32mol×25%=8mol,故答案为:8mol;
(3)N2(g)+3H2(g) 2NH3(g),
2NH3(g),
开始16 b 0
转化412 8
平衡12(32-12-8)8
n(始):n(平)=(16+24):((12+12+8)=40:32=5:4,故答案为:5:4;
(4)由上述解答可知,b=12+(32-12-8)=24mol,a=16mol,所以a:b=16mol:24mol=2:3,故答案为:2:3;
(5)达到平衡时,N2和H2的转化率之比a(N2):a(H2)=416:0.5=1:2,故答案为:1:2;
(6)平衡混合气体中,n(N2):n(H2):n(NH3)=12mol:12mol:8mol=3:3:2,故答案为:3:3:2;
II、(1)N2(g)+3H2(g)?2NH3(g),
开始 2 6 0
开始0 0 4
在温度、体积不变的条件下,达到相同的平衡状态,则c=4mol,故答案为:4mol;
(2)①根据N2(g)+3H2(g)?2NH3(g),
开始0.7 2.1 c
转化0.5c
将c极限转化为a,即0.5c+0.7=2,解得c=2.6,故答案为:2.6;
②根据N2(g)+3H2(g)?2NH3(g),
开始2 6 0
转化x 3x 2x
平衡 2-x 6-3x 2x
2-x+6-3x+2x=7,解得x=0.5,
即平衡时物质的量分别为1.5mol、4.5mol、1mol,
当a、b、c分别为0.7、2.1、2.6时,浓度商>平衡常数(Q>K),则化学反应逆向移动,
故答案为:逆反应方向;(2分);浓度商>平衡常数;
③因平衡时c为1,c的最大值为4,则要维持反应开始向该反应方向进行,应满足1<c≤4,故答案为:1<c≤4;
(3)欲使起始反应维持向与②相反的方向进行,即反应向正向移动,平衡时b=4.5,b的最大值为6,则满足4.5<b≤6即可,
故答案为:4.5<b≤6.
本题解析:
本题难度:一般